Estrutura de carbono oco dopado com cobalto como hospedeiro de enxofre para o cátodo da bateria de enxofre de lítio
Autor: JIN Gaoyao, HE Haichuan, WU Jie, ZHANG Mengyuan, LI Yajuan, LIU Younian. Estrutura de carbono oco dopado com cobalto como hospedeiro de enxofre para o cátodo da bateria de enxofre de lítio. Journal of Inorganic Materials [J], 2021, 36(2): 203-209 DOI:10.15541/jim20200161
TOB New Energy fornece vários materiais de bateria para bateria de íon de lítio , de sódio, bateria de lítio-enxofre, bateria de estado sólido, célula de combustível , etc. Entre em contato conosco para cotação.
Embora o desempenho do cátodo possa ser melhorado até certo ponto com a sinergia de heteroátomos e estrutura de carbono, ainda é significativamente limitado pela cinética lenta da reação de conversão de polissulfeto, que causa o acúmulo excessivo de LiPSs e a difusão inevitável. Compostos de metais de transição têm sido amplamente introduzidos no hospedeiro de enxofre para acelerar a cinética da reação de conversão. Nos últimos anos, nanopartículas metálicas específicas, como Co, Fe e Pt, mostraram efeito acelerador semelhante. Dentre esses metais, o metal cobalto tem atraído a atenção de pesquisadores por sua excelente condutividade e forte interação com polissulfetos. Durante o processo de carga e descarga, ele pode capturar efetivamente os polissulfetos e promover a reação de conversão. Li, et ai. obteve o carbono dopado com Co e N como hospedeiro de enxofre pela calcinação do precursor ZIF-67. As nanopartículas de Co uniformemente dispersas aceleraram distintamente a reação redox com o efeito sinérgico de grupos N-dopados. Além disso, Du, et al. apresentaram os átomos de cobalto monodispersos em catodo de grafeno dopado com nitrogênio, e Wu, et al.fabricaram nanopontos de Co/carbono mesoporoso dopado com N com a calcinação in-situ de adenina e CoCl2. Em todos esses relatórios, os sistemas Co-contained obtiveram excelentes desempenhos de ciclismo. fabricados nanopontos de Co/carbono mesoporoso dopado com N com a calcinação in situ de adenina e CoCl2. Em todos esses relatórios, os sistemas Co-contained obtiveram excelentes desempenhos de ciclismo. fabricados nanopontos de Co/carbono mesoporoso dopado com N com a calcinação in situ de adenina e CoCl2. Em todos esses relatórios, os sistemas Co-contained obtiveram excelentes desempenhos de ciclismo.
Neste trabalho, para melhorar o desempenho cíclico e de taxa de baterias Li-S, uma estrutura de carbono oca 3D decorada com nanopartículas de cobalto foi projetada como hospedeira do cátodo de enxofre. O citrato de sódio, um aditivo barato e abundante, é empregado como fonte de carbono por seu caráter único durante a calcinação direta. E o desempenho eletroquímico do sistema contendo cobalto (Co/C-700) e estrutura de carbono (HEC-700) foi sistematicamente avaliado para garantir o efeito de nanopartículas de cobalto dopado para o cátodo de enxofre.
1 Experimental
1.1 Síntese de materiais
Todos os reagentes químicos utilizados neste trabalho eram de grau analítico sem purificação adicional. Resumidamente, 0,25 g de Co(NO3)2·6H2O e 5,0 g de citrato de sódio foram dissolvidos em 20 mL de água desionizada sob agitação magnética para formar uma solução homogênea. Em seguida, a solução foi liofilizada, moída em pó fino e calcinada a 700 ℃ sob N2 por 1 h com uma taxa de aquecimento de 5 ℃∙min-1. Os compósitos obtidos (denominados UWC-700) foram lavados com água deionizada por 3 vezes para remover os subprodutos. Após ser seco a 60 ℃ durante a noite, o produto final foi coletado e denotado como Co/C-700. Para confirmar ainda mais o efeito do Co, o carbono gravado com ácido clorídrico (HEC-700) foi obtido gravando Co/C-700 em 2 mol/L HCl por 12 h, lavando até a neutralidade e secando a 80 ℃ por 12 h.
Os compósitos catódicos foram preparados através de um método convencional de difusão por fusão. Em resumo, uma mistura de compósitos de enxofre (70% em peso) e Co/C-700 (ou HEC-700) foi moída por 20 min, transferida para uma autoclave de recipiente de Teflon de 20 mL e aquecida a 155 ℃ por 12 h. O pó obtido foi coletado como S@Co/C-700 e S@HEC-700. A caracterização dos materiais e a adsorção estática de polissulfetos são mostradas em materiais de suporte.
1.2 Caracterização eletroquímica
O desempenho eletroquímico dos cátodos S@Co/C-700 e S@HEC-700 foi testado por células tipo moeda CR2025, fabricadas em um porta-luvas preenchido com argônio (MBraun, Alemanha). A pasta de cátodo de enxofre foi preparada misturando S@Co/C-700 (ou S@HEC-700), aglutinante de preto de acetileno e difluoreto de polivinilideno (PVDF) com uma razão em peso de 7:2:1 em N-metil-2- pirrolidinona (NMP). Em seguida, a pasta obtida foi moldada uniformemente em uma folha de Al. Além disso, a membrana foi seca a 50 ℃ sob vácuo durante a noite e cortada em discos (1 cm de diâmetro) com uma carga de enxofre de 1,1-1,7 mg∙cm-2. A membrana de polipropileno de rotina (Celgard 2400) foi usada para separar o cátodo e o ânodo de lítio. O eletrólito usado em cada célula foi 50 μL 1mol/L LiN(CF3SO2)2 e 1% em peso de solução de LiNO3 em DOL/DME (1:1 em volume). Os testes de descarga de carga galvanostática foram realizados por um sistema de teste de bateria LAND CT 2001A (Jinnuo Electronic Co, Wuhan, China) dentro da janela de tensão de 1,7-2,8 V. A medição de voltametria cíclica (CV) foi realizada de 1,5 a 3,0 V em um taxa de varredura de 0,1 mV∙s-1. A espectroscopia de impedância eletroquímica (EIS) foi realizada na faixa de frequência de 0,1 MHz a 10 mHz com amplitude de tensão de 5 mV em circuito aberto. As medições de CV e EIS foram realizadas em uma estação de trabalho eletroquímica CHI 660E (Chenhua Instruments Co, Xangai, China). As células simétricas foram montadas com Co/C-700 ou HEC-700 (8:2 com PVDF na proporção em peso) como cátodo e ânodo idênticos e 50 μL de eletrólito de 1 mol/L LiN(CF3SO2)2, 1% em peso de LiNO3 e 0,2 mol/L Li2S6 em solução DOL/DME (1:1 em volume). China) dentro da janela de tensão de 1,7-2,8 V. A medição da voltametria cíclica (CV) foi realizada de 1,5 a 3,0 V a uma taxa de varredura de 0,1 mV∙s-1. A espectroscopia de impedância eletroquímica (EIS) foi realizada na faixa de frequência de 0,1 MHz a 10 mHz com amplitude de tensão de 5 mV em circuito aberto. As medições de CV e EIS foram realizadas em uma estação de trabalho eletroquímica CHI 660E (Chenhua Instruments Co, Xangai, China). As células simétricas foram montadas com Co/C-700 ou HEC-700 (8:2 com PVDF na proporção em peso) como cátodo e ânodo idênticos e 50 μL de eletrólito de 1 mol/L LiN(CF3SO2)2, 1% em peso de LiNO3 e 0,2 mol/L Li2S6 em solução DOL/DME (1:1 em volume). China) dentro da janela de tensão de 1,7-2,8 V. A medição da voltametria cíclica (CV) foi realizada de 1,5 a 3,0 V a uma taxa de varredura de 0,1 mV∙s-1. A espectroscopia de impedância eletroquímica (EIS) foi realizada na faixa de frequência de 0,1 MHz a 10 mHz com amplitude de tensão de 5 mV em circuito aberto. As medições de CV e EIS foram realizadas em uma estação de trabalho eletroquímica CHI 660E (Chenhua Instruments Co, Xangai, China). As células simétricas foram montadas com Co/C-700 ou HEC-700 (8:2 com PVDF na proporção em peso) como cátodo e ânodo idênticos e 50 μL de eletrólito de 1 mol/L LiN(CF3SO2)2, 1% em peso de LiNO3 e 0,2 mol/L Li2S6 em solução DOL/DME (1:1 em volume). A espectroscopia de impedância eletroquímica (EIS) foi realizada na faixa de frequência de 0,1 MHz a 10 mHz com amplitude de tensão de 5 mV em circuito aberto. As medições de CV e EIS foram realizadas em uma estação de trabalho eletroquímica CHI 660E (Chenhua Instruments Co, Xangai, China). As células simétricas foram montadas com Co/C-700 ou HEC-700 (8:2 com PVDF na proporção em peso) como cátodo e ânodo idênticos e 50 μL de eletrólito de 1 mol/L LiN(CF3SO2)2, 1% em peso de LiNO3 e 0,2 mol/L Li2S6 em solução DOL/DME (1:1 em volume). A espectroscopia de impedância eletroquímica (EIS) foi realizada na faixa de frequência de 0,1 MHz a 10 mHz com amplitude de tensão de 5 mV em circuito aberto. As medições de CV e EIS foram realizadas em uma estação de trabalho eletroquímica CHI 660E (Chenhua Instruments Co, Xangai, China). As células simétricas foram montadas com Co/C-700 ou HEC-700 (8:2 com PVDF na proporção em peso) como cátodo e ânodo idênticos e 50 μL de eletrólito de 1 mol/L LiN(CF3SO2)2, 1% em peso de LiNO3 e 0,2 mol/L Li2S6 em solução DOL/DME (1:1 em volume).
2 Resultados e discussão
A Fig. 1 mostra a ilustração esquemática do procedimento sintético para compósito de carbono dopado com cobalto tridimensional (3D). Quando o citrato de sódio (SC) foi recozido em atmosfera inerte, as espécies de Na+ se transformaram em cristais de Na2CO3 enquanto nanofolhas de carbono ultrafinas apareceram na superfície. Com o aumento da temperatura, os cristais atuam como agente ativador e reagem com o carbono revestido para formar as cascas porosas estratificadas. Enquanto isso, os elementos de cobalto foram transformados em nanopartículas de Co e incorporados na estrutura de carbono com a redução térmica do carbono.
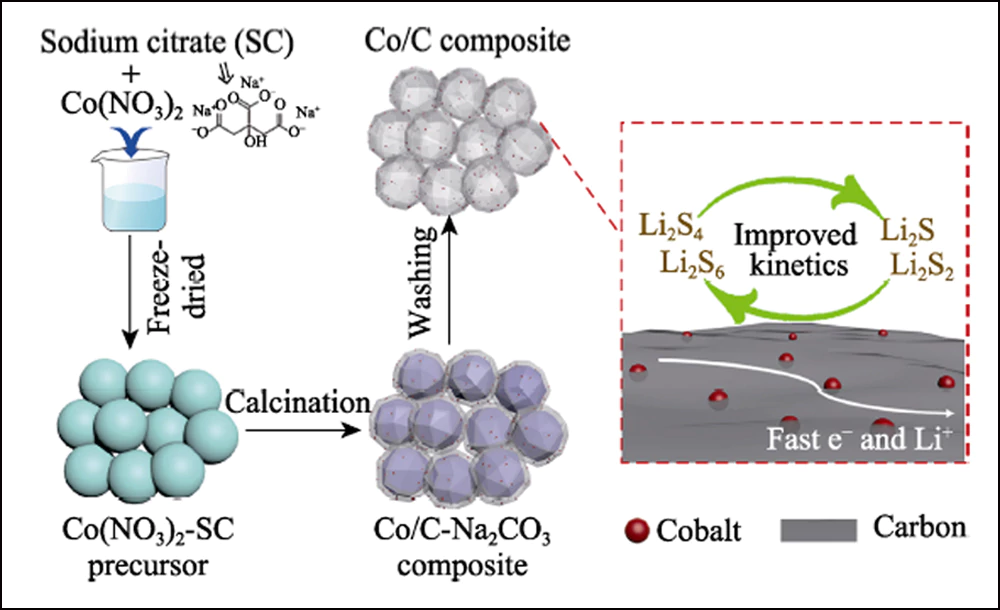
Fig. 1 Ilustração esquemática para as etapas de síntese do compósito de Co/C oco e seu efeito para o eletrodo resultante
A composição e estrutura cristalina de UWC-700 e Co/C-700 foram caracterizadas por DRX. Os principais picos de difração de UWC-700 (Fig. S1) são consistentes com Na2CO3 monoclínico (PDF#72-0628), enquanto outros três picos em 2θ=44,2°, 51,5° e 75,9° se encaixam bem com dados cristalinos de Co (PDF #15-0806), indicando a decomposição total do SC e redução do elemento cobalto. O padrão XRD de Co/C-700 (Fig. 2(a)) com apenas picos característicos de metal cobalto sugere a remoção completa de Na2CO3. Além disso, o pico largo óbvio em torno de 2θ = 26° representa o plano (002) do carbono grafitado. Enquanto isso, como mostrado nos espectros Raman (Fig. 2(b)) de Co/C-700, a razão de intensidade para as duas bandas óbvias de D (1382 cm-1) e G (1594 cm-1) é 0,866, respondendo ao seu alto grau de grafitização. Além disso, o pequeno pico em 680 cm-1 é o pico característico do cobalto. A curva TGA de Co/C-700 é mostrada na Fig. S2(a) para garantir o teor de Co. O produto final (17,83% em peso) após o teste de TGA pode ser identificado como Co3O4 (Fig. S2(b)), e o teor de Co correspondente em Co/C-700 é de 13,09% em peso por cálculo, o que se ajusta bem ao resultado XPS (Fig. 2(c)), as razões atômicas e em peso de Co são 3,24% em peso e 13,66% em peso, respectivamente.
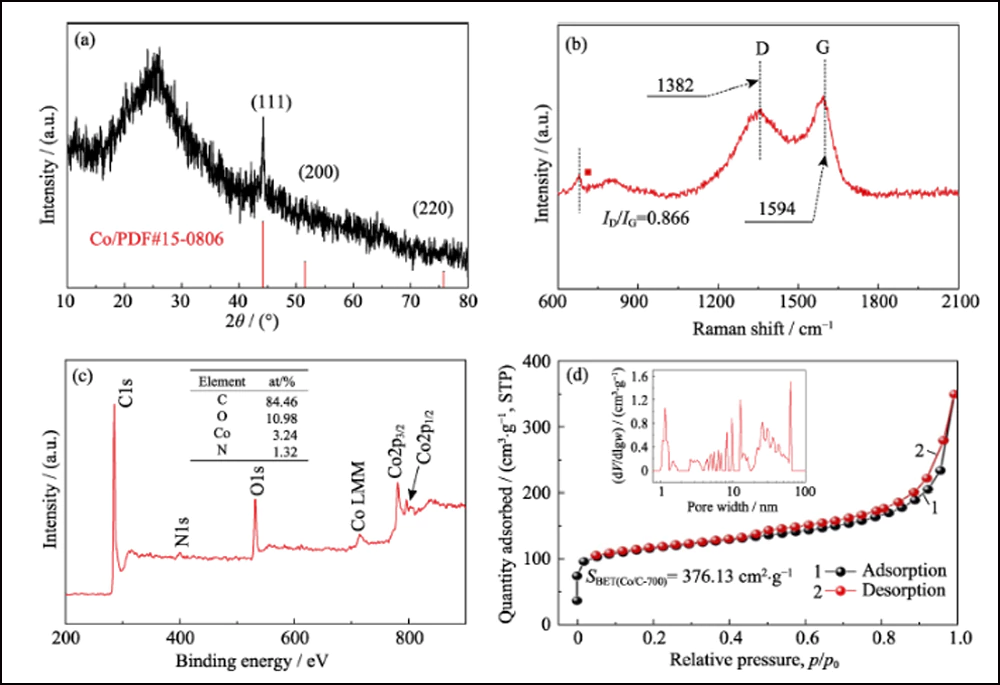
Fig. 2 (a) padrão de XRD, (b) espectro Raman, (c) espectro XPS e (d) isoterma de adsorção/dessorção de N2 de Co/C-700 com inserção em (d) mostrando a distribuição do tamanho dos poros
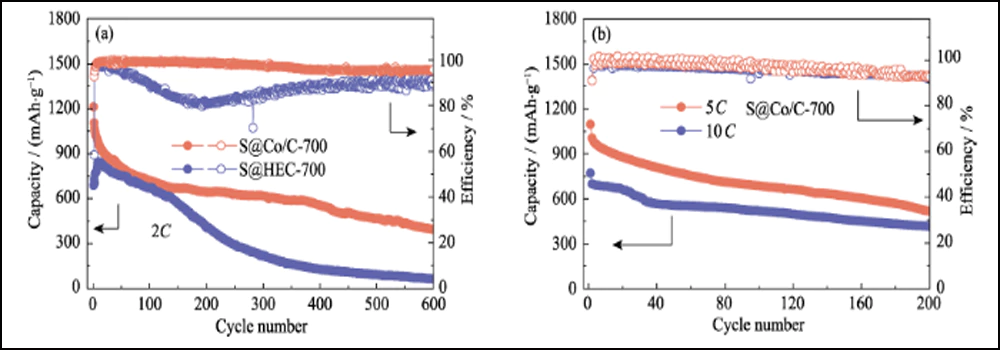
Fig. S1 padrão XRD do UWC-700
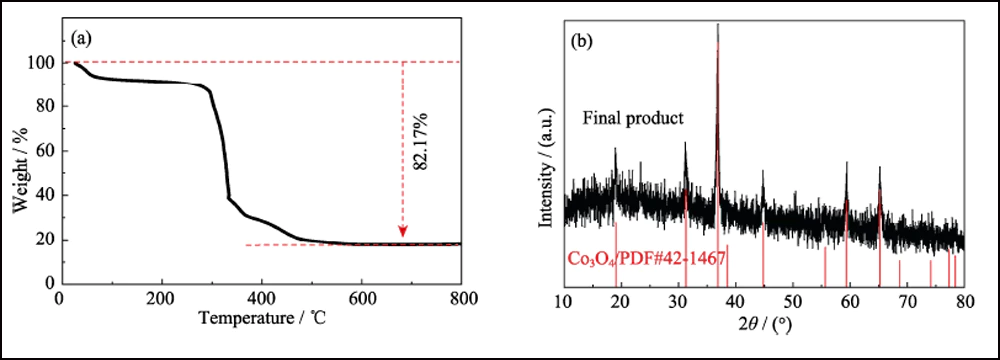
Fig. S2 (a) curva TGA de Co/C-700 no ar e (b) padrão de XRD do produto final
A estrutura porosa do Co/C foi caracterizada pelos métodos BET. A isoterma de adsorção-dessorção de N2 (Fig. 2(d)) mostra uma alça de histerese distinta, representando a estrutura mesoporosa abundante. O valor da área superficial específica e o volume dos poros foram medidos em 376,13 m2∙g-1 e 0,52 cm3∙g-1, respectivamente. A distribuição do tamanho dos poros (inserção na Fig. 2(d)) determinada pelo método de Barrett-Joyner-Halenda (BJH) mostra uma estrutura distinta hierarquicamente porosa com alta mesoporosidade (62,76%, Tabela S1). O mesoporo interconectado e a alta área de superfície podem expor adequadamente os sítios de cobalto para adsorção e aumento adicional da reação redox. Além disso, os mesmos testes foram realizados com as outras duas amostras, UWC-700 e HEC-700 (Fig. S3). A área de superfície extremamente baixa (15,09 m2∙g-1) e o volume de poros (0. 026 cm3∙g-1) de UWC-700 mostram que a maioria dos poros são preenchidos com cristais de Na2CO3. A área de superfície e o volume de poros do HEC-700 são quase os mesmos do Co/C-700, o que significa a preservação da estrutura de carbono durante as etapas de ataque. Além disso, o volume de mesoporo em HEC-700 (Tabela S1) aumentou 5,4% após o ataque, confirmando que as nanopartículas de Co estavam em tamanho mesoporoso.
A morfologia e estrutura de Co/C-700 foram caracterizadas por SEM (Fig. S4) e TEM (Fig. 3(a, b)). As partículas de Co/C-700 mostram a estrutura da casca de carbono interconectada em 3D. A imagem TEM de alta resolução (HRTEM) (Fig. 3(c)) mostra ainda que as franjas de rede da nanopartícula com um espaçamento d de 0,205 nm correspondem ao plano (111) de cobalto metálico. O espaçamento d das franjas tortas envolvendo a nanopartícula (0,35 nm) está em boa concordância com o plano (002) do carbono grafítico. As imagens de mapeamento EDS (Fig. 3(d)) mostram a distribuição dos elementos Co, C e O, confirmando que o elemento cobalto se dispersa uniformemente nas camadas de carbono.
Tabela S1 BET área de superfície e distribuição de volume de poros de UWC-700, Co/C-700 e HEC-700
|
Amostra |
SBET/(m2∙g-1) |
Vtotal/(cm3∙g-1) |
Volume do poro e/% |
||
|
Micro |
Meso |
Macro |
|||
|
UWC-700 |
15.09 |
0,026 |
1,76 |
98,24 |
0 |
|
Co/C-700 |
376,13 |
0,52 |
28,85 |
62,76 |
8,49 |
|
HEC-700 |
369,53 |
0,54 |
25,47 |
68,17 |
6,36 |

Fig. 3 (a, b) TEM, (c) imagens TEM de alta resolução (HRTEM) e (d) mapeamentos elementares EDS (Co, C e O) de Co/C-700
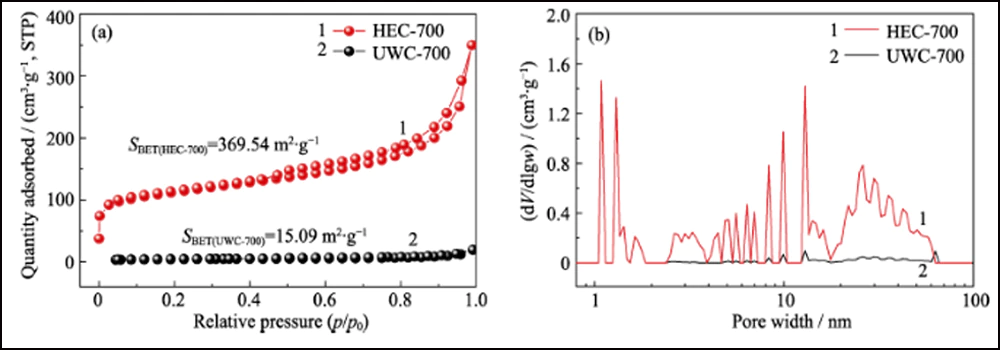
Fig. S3 N2 isotermas de adsorção/dessorção (a) e distribuições de tamanho de poro (b) de UWC-700 e HEC-700

Fig. S4 imagem SEM de Co/C-700
Para confirmar ainda mais o efeito eletroquímico de Conanoparticles em baterias Li-S, HEC-700 foi empregado como amostra de controle. O padrão XRD, a imagem SEM (Fig. S5) e os dados BET mostram que o HEC-700 possui quase a mesma estrutura do Co/C-700, exceto pela existência do elemento Co. Os eletrodos S@Co/C-700 e S@HEC-700 foram preparados como cátodos para baterias Li-S. Conforme mostrado na Fig. S6, a principal perda de peso entre a temperatura ambiente e 450 ℃ é atribuída à sublimação de enxofre, correspondendo ao teor de enxofre de 70,99% em peso e 68,42% em peso em S@Co/C-700 e S@HEC - 700, respectivamente.
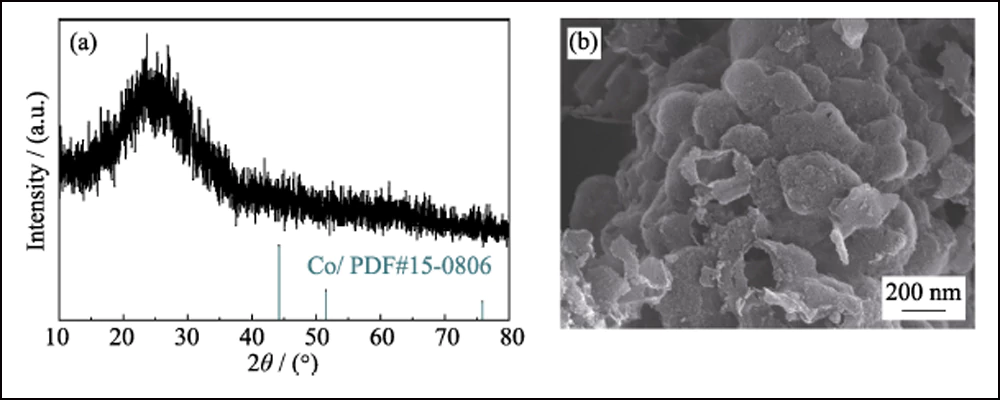
Fig. S5 padrão XRD (a) e imagem SEM (b) de HEC-700
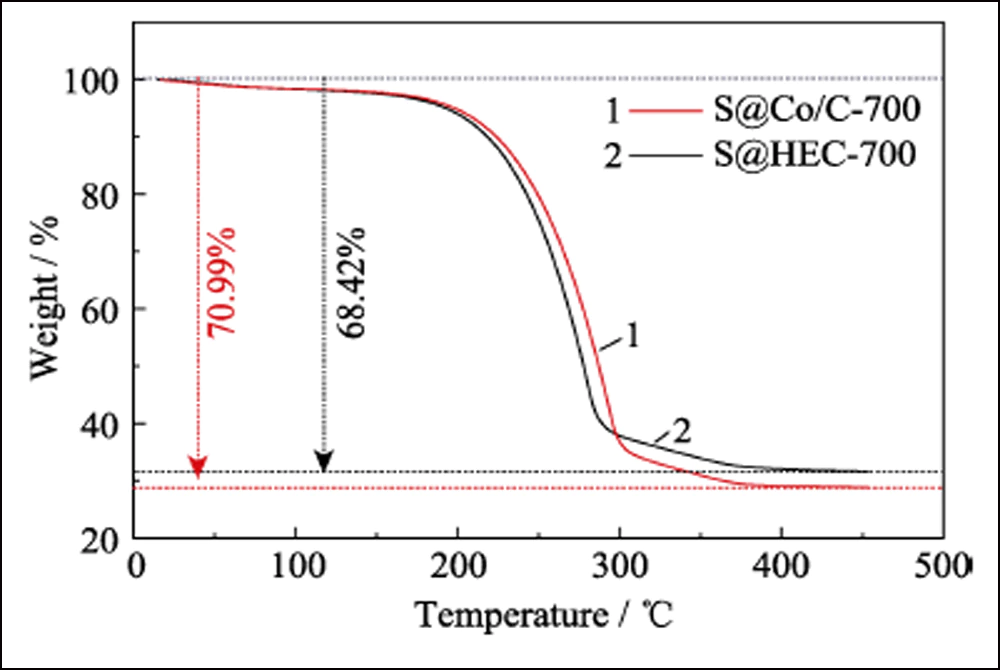
Fig. Curvas S6 TGA de S@Co/C-700 e S@HEC-700 sob atmosfera de N2
A composição da superfície de S@Co/C-700 foi investigada por XPS. O espectro de levantamento (Fig. S7) mostra a presença de elementos S, C, N, O e Co na superfície do compósito. O pouco N é do precursor de Co(NO3)2. A proporção extremamente baixa de enxofre (7,83at%) indica que o cristal de enxofre se infiltrou com sucesso na estrutura porosa. O espectro de alta resolução de S2p (Fig. 4(a)) mostra quatro picos principais. Os picos em 164 e 165,2 eV correspondem a S2p3/2 e S2p1/2, respectivamente. Os picos localizados em 169 e 170,1 eV são atribuídos ao tiossulfato e S-Co, respectivamente. O espectro C1s é apresentado na Fig. 4(b). Os picos em 284,8, 285,6 e 288,8 eV correspondem a ligações CC, CO e O=CO, quase o mesmo que o espectro C1s de Co/C-700 (Fig. S8(a)). E o espectro de O1s (Fig. 4(c)) mostra o O=C, OC e O=CO a 531,6, 532,4 e 533,4 eV, respectivamente. Quando comparados com Co/C-700 (Fig. S8(b)), todos esses picos se deslocam mais de 0,5 eV e verificam ainda mais a interação entre os grupos funcionais enxofre e oxigênio. Além disso, o espectro de Co2p na Fig. 4(d) mostra dois picos principais de Co2p3/2 e Co2p1/2 em 780,3 e 797,9 eV, que representam o metal cobalto. Diferente das curvas de Co/C-700 (Fig. S8(c)), dois picos extras aparecem em 783,7 e 800,4 eV em S@Co/C-700 que sugerem a forte interação entre enxofre e cobalto. O teste de adsorção estática foi empregado para investigar a interação entre LiPSs e Co/C-700 ou HEC-700 de forma mais intuitiva. E a fotografia revela a solução incolor de Co/C-700 e a cor quase inalterada de HEC-700 (Fig. S9).
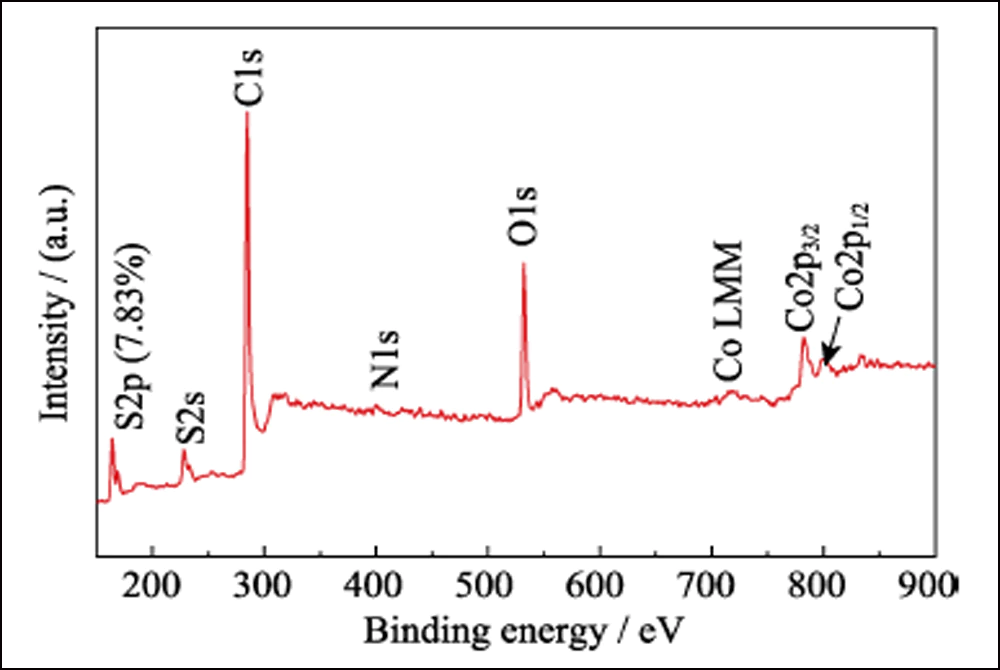
Fig. Espectro S7 XPS do compósito S@Co/C-700
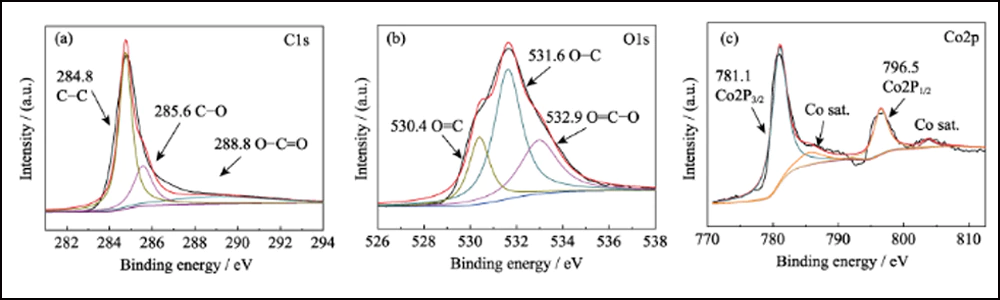
Fig. S8 Espectros XPS de alta resolução de Co/C-700(a) C1s; (b) O1s; (c) Co2p
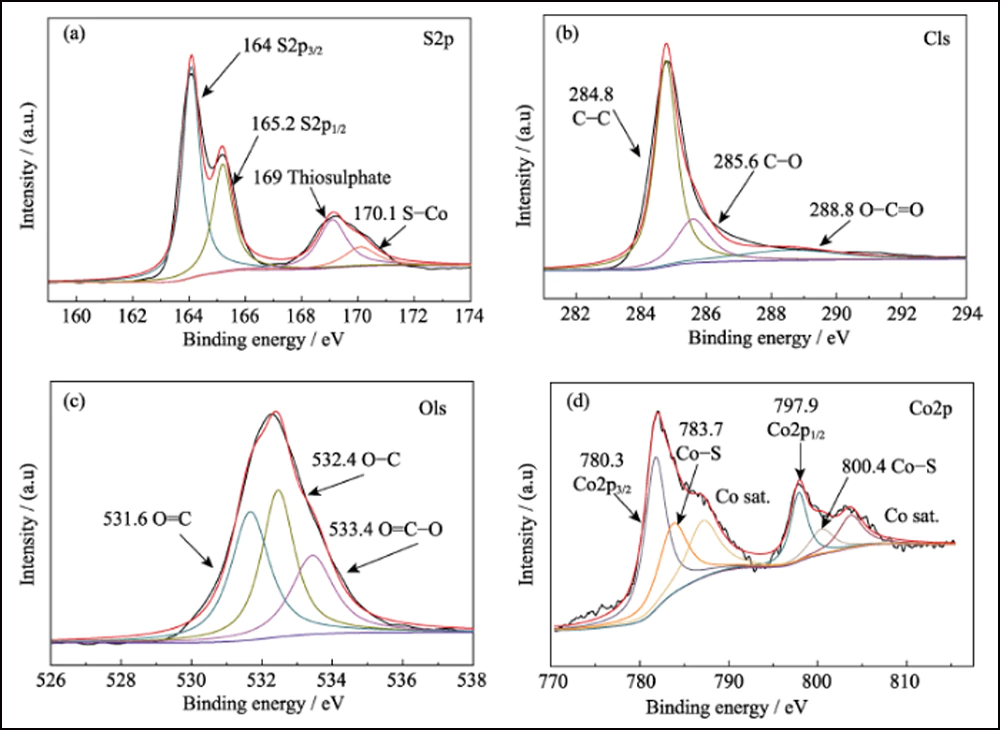
Fig. 4 Espectros XPS de alta resolução para compósitos S@Co/C-700
(a) S2p; (b) C1s; (c) O1s; (d) Co2p

Fig. S9 Fotografia do teste de adsorção estática de HEC-700 e Co/C-700 após repouso por 1 h
Além da adsorção efetiva e forte interação, as nanopartículas de cobalto dopado podem melhorar eficientemente a cinética da reação de conversão entre S8 e Li2S. A voltametria cíclica (CV) das células simétricas com eletrodos de Co/C-700 e HEC-700 foi utilizada para confirmar o efeito das nanopartículas de cobalto. As curvas CV na Fig. 5(a) revelam claramente oito picos redox com grande sobreposição (Fig. S10(a)). A separação e estabilidade dos picos redox indicam a reversibilidade e cinética melhoradas da reação de conversão. Além disso, a curva da primeira varredura para -1 V revela três picos que representam a redução gradual de Li2S6 original para Li2S insolúvel no eletrodo de trabalho e oxidação de Li2S6 no contra eletrodo. Os quatro picos em -0,112, 0,093, 0,326 e 0. 401 V representam a oxidação gradual do Li2S ao elemento enxofre no eletrodo de trabalho. Portanto, o pico em 0,112 V corresponde à redução de S8 para Li2S6. Além disso, os picos com boa sustentabilidade sob maiores taxas de varredura (Fig. S10(b)) também indicam o processo eletroquímico eficiente baseado nos eletrodos Co/C-700. Em contraste, o controle experimental dos eletrodos HEC-700 mostra apenas dois pares de picos largos (Fig. 5(b)) com a deriva cíclica (Fig. S10(c)), e os picos imperceptíveis em -0,264/0,264 V tornam-se invisível sob taxas mais altas (Fig. S10(d)), indicando a cinética lenta e conversão incompleta da reação de polissulfetos sem a existência de nanopartículas de Co. os picos com boa sustentabilidade sob maiores taxas de varredura (Fig. S10(b)) também indicam o processo eletroquímico eficiente baseado nos eletrodos Co/C-700. Em contraste, o controle experimental dos eletrodos HEC-700 mostra apenas dois pares de picos largos (Fig. 5(b)) com a deriva cíclica (Fig. S10(c)), e os picos imperceptíveis em -0,264/0,264 V tornam-se invisível sob taxas mais altas (Fig. S10(d)), indicando a cinética lenta e conversão incompleta da reação de polissulfetos sem a existência de nanopartículas de Co. os picos com boa sustentabilidade sob maiores taxas de varredura (Fig. S10(b)) também indicam o processo eletroquímico eficiente baseado nos eletrodos Co/C-700. Em contraste, o controle experimental dos eletrodos HEC-700 mostra apenas dois pares de picos largos (Fig. 5(b)) com a deriva cíclica (Fig. S10(c)), e os picos imperceptíveis em -0,264/0,264 V tornam-se invisível sob taxas mais altas (Fig. S10(d)), indicando a cinética lenta e conversão incompleta da reação de polissulfetos sem a existência de nanopartículas de Co.
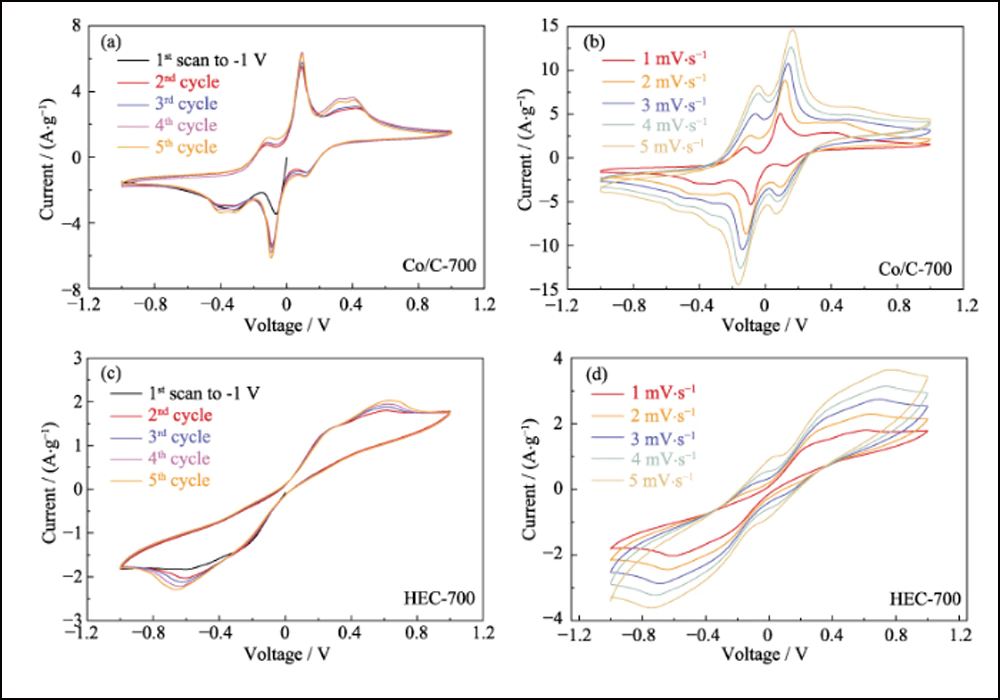
Fig. S10 Curvas CV multiciclo de células simétricas baseadas em Co/C-700 a 1 mV∙s-1 (a) e taxas aumentadas (b), e curvas CV multiciclo de HEC-700 a 1 mV∙s- 1 (c) e taxas aumentadas (d)
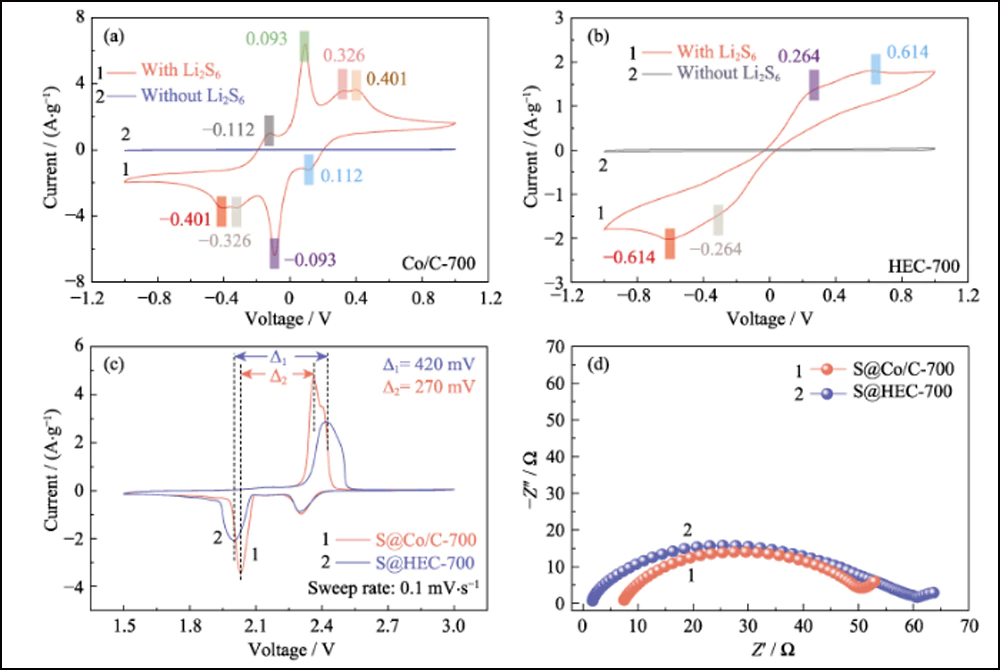
Fig. 5 Curvas CV de (a) Co/C-700 e (b) células simétricas baseadas em HEC-700 com e sem 0,2 mol∙L-1 Li2S6 a 1 mV∙s-1; (c) curvas CV e (d) gráficos EIS de eletrodos S@Co/C-700 e S@HEC-700
Para confirmar ainda mais a cinética eletroquímica aprimorada na presença de nanopartículas de cobalto, os testes de CV dos eletrodos S@Co/C-700 e S@HEC-700 (Fig. 5(c)) foram medidos a uma taxa de varredura de 0,1 mV∙ s-1. Para o processo de redução catódica de S@Co/C-700, dois picos reversíveis em 2,306 e 2,031 V estão associados à transformação de enxofre em LiPSs solúveis e redução adicional em Li2S2/Li2S insolúvel, respectivamente. Em comparação, o último pico de redução de S@HEC-700 mostra um deslocamento negativo significativo. Sugere a cinética de reação mais lenta, o que pode aumentar o tempo de detenção de LiPSs e agravar o efeito de vaivém. Para o processo anódico, o processo de oxidação de S@Co/C-700 revela um pico discreto em 2,397 V e um pico maior em 2,361 V, correspondendo à oxidação de Li2S2/Li2S a LiPSs e posteriormente a enxofre, respectivamente. A separação dos picos de oxidação mostra a cinética aprimorada da primeira reação. Além disso, o intervalo entre o segundo pico de redução e o principal pico de oxidação de S@Co/C-700 (270 mV, Fig. 5(c)) é significativamente menor do que o de S@HEC-700 (420 mV), indicando o sobrepotencial de polarização reduzido e cinética melhorada da reação redox com a existência de cobalto. As curvas EIS (Fig. 5(d)) mostram menor resistência à transferência de carga (o tamanho do semicírculo de alta frequência) do eletrodo S@Co/C-700 (43,1 Ω) do que a do S@HEC-700 (58,7 Ω ), o que também revela a cinética de reação aprimorada pelo cobalto. 5(c)) é significativamente menor do que S@HEC-700 (420 mV), indicando o sobrepotencial de polarização reduzido e cinética melhorada da reação redox com a existência de cobalto. As curvas EIS (Fig. 5(d)) mostram menor resistência à transferência de carga (o tamanho do semicírculo de alta frequência) do eletrodo S@Co/C-700 (43,1 Ω) do que a do S@HEC-700 (58,7 Ω ), o que também revela a cinética de reação aprimorada pelo cobalto. 5(c)) é significativamente menor do que S@HEC-700 (420 mV), indicando o sobrepotencial de polarização reduzido e cinética melhorada da reação redox com a existência de cobalto. As curvas EIS (Fig. 5(d)) mostram menor resistência à transferência de carga (o tamanho do semicírculo de alta frequência) do eletrodo S@Co/C-700 (43,1 Ω) do que a do S@HEC-700 (58,7 Ω ), o que também revela a cinética de reação aprimorada pelo cobalto.
A Fig. 6 compara o desempenho eletroquímico dos cátodos S@Co/C-700 e S@HEC-700. As capacidades de taxa de S@Co/C-700 (Fig. 6(a)) mostram uma capacidade de descarga inicial muito maior (1280 mAh∙g-1) do que S@HEC-700 (847 mAh∙g-1) no taxa de corrente de 0,5C (1C = 1672 mAh∙g-1). Em taxas de ciclagem mais altas de 1C, 2C, 5C e 10C, as capacidades de descarga do cátodo S@Co/C-700 atingem 1058, 948, 867 e 797 mAh∙g-1 e recuperam ainda mais para 968 mAh∙g-1 em 1C (95% do 10º ciclo). E os perfis de tensão de carga-descarga galvanostática em diferentes taxas mostram que o eletrodo S@Co/C-700 exerce um platô de descarga de sobrepotencial menor e muito mais longo, mesmo a 10C (Fig. S11). As estabilidades de ciclo dos dois cátodos à taxa de 1C são comparadas na Fig. 6(b). O cátodo S@Co/C-700 apresenta uma alta capacidade inicial de 1244 mAh∙g-1, e mantém 770 mAh∙g-1 após 200 ciclos com alta eficiência Coulomb (superior a 96%), revelando capacidade muito maior e melhor estabilidade que o S@HEC-700. Os desempenhos de ciclismo de longo prazo em 2C exibidos na Fig. S12(a). Após 600 ciclos, o cátodo S@Co/C-700 manteve uma capacidade de descarga de 401,7 mAh∙g-1 (65,3 mAh∙g-1 para S@HEC-700). As taxas extremamente altas em 5C e 10C são ainda avaliadas para o cátodo S@Co/C-700 (Fig. S12(b)). Ele mostra altas capacidades de descarga inicial (1098 e 772 mAh∙g-1 a 5C e 10C, respectivamente) sem qualquer etapa de ativação e desempenho de ciclagem estável (518 e 416 mAh∙g-1 a 5C e 10C, respectivamente) por mais de 200 ciclos. A estabilidade de ciclo e desempenho de taxa mais excelentes do eletrodo S@Co/C-700 são atribuídos aos benefícios das nanopartículas de cobalto.
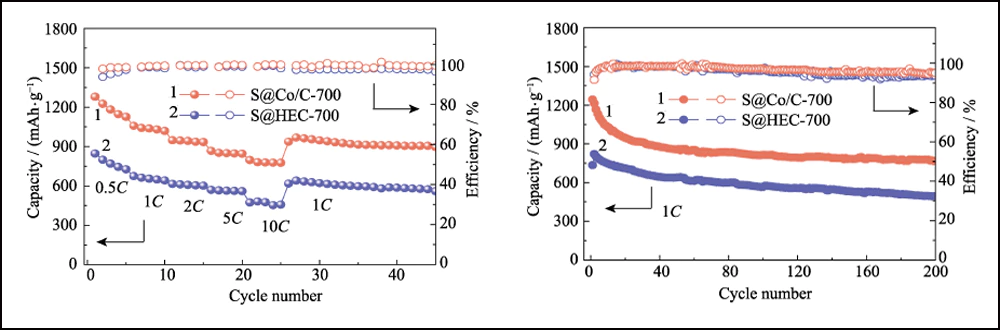
Fig. 6 (a) Capacidades de taxa em várias taxas de 0,5C a 10C e (b) estabilidades de ciclagem a 1C para eletrodos S@Co/C-700 e S@HEC-700
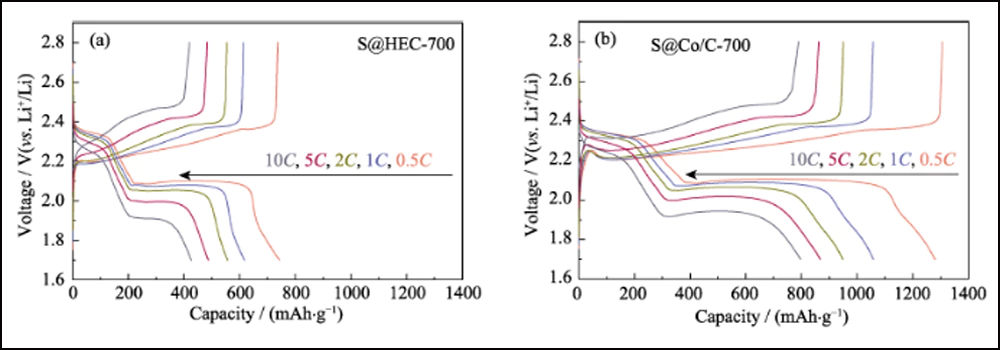
Fig. S11 Perfis de tensão dos eletrodos S@HEC-700 (a) e S@Co/C-700 (b) em várias taxas de 0,5C a 10C
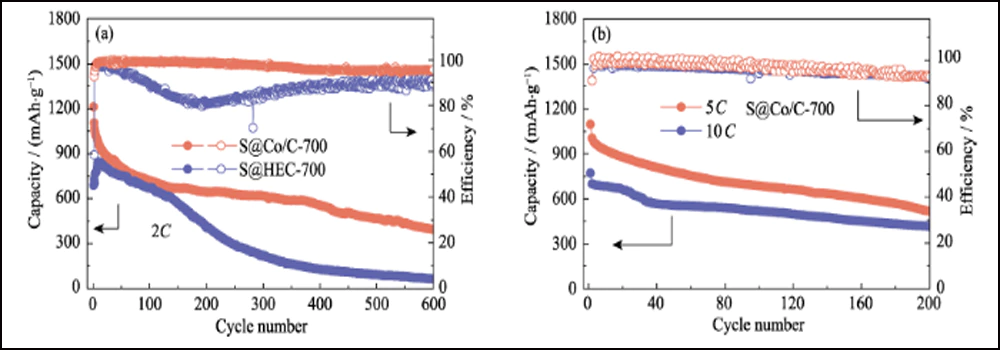
Fig. S12 (a) Estabilidades de ciclagem dos eletrodos S@Co/C-700 e S@HEC-700 a 2C; (b) Desempenho de ciclagem de S@Co/C-700 a 5C e 10C
3 Conclusão
Em resumo, projetamos uma síntese em larga escala de compósitos Co/C-700 como material hospedeiro para suportar enxofre para baterias Li-S. Combinando com os resultados de CV e EIS, concluímos que as nanopartículas de Co incorporadas diminuem o sobrepotencial e promovem a cinética de conversão de LiPSs. Além disso, o XPS e o teste de adsorção estática mostram a forte interação entre LiPSs e o Co dopado. Com a cooperação do Co e a estrutura porosa oca única, os cátodos S@Co/C-700 obtidos exibem alta capacidade específica de 1280 mAh∙g -1 a 0,5C e desempenho de ciclo longo estável de 1C a 10C. Este trabalho demonstra a viabilidade de baterias Li-S de alta densidade de energia com o dopante de metal cobalto para requisitos de alta taxa.
Materiais de suporte
Estrutura de carbono oco dopado com cobalto como hospedeiro de enxofre para o cátodo da bateria de enxofre de lítio
JIN Gaoyao, HE Haichuan, WU Jie, ZHANG Mengyuan, LI Yajuan, LIU Younian
Laboratório-Chave da Província de Hunan de Ciência de Interface de Micro e Nano Materiais, Faculdade de Química e Engenharia Química, Universidade Centro-Sul, Changsha 410083, China
Caracterização de materiais
As estruturas cristalinas das amostras sintetizadas foram caracterizadas por difração de potência de raios X (DRX, Dmax/2550VB, Rigaku, Japão) com radiação Cu Kα. A morfologia da superfície e a microestrutura foram obtidas por microscopia eletrônica de varredura (SEM, FEI Verios 460). A microscopia eletrônica de transmissão (TEM, JEM-2100F) equipada com um espectrômetro dispersivo de energia de raios-X (EDS) foi usada para coletar imagens de transmissão e alta resolução do Co/C-700. O teor de Co em Co/C-700 e o teor de S em S@Co/C-700 ou S@HEC-700 foram determinados por analisador termogravimétrico (TGA, Q600, EUA) em ar ou N2, respectivamente, com taxa de aquecimento de 10 ℃∙min-1. A espectroscopia Raman foi realizada usando um sistema Raman reflexo (Renishaw in Via Raman microscópio, Reino Unido) equipado com um microscópio sob radiação laser de 532 nm a 50 mW. A análise do espectrômetro de fotoelétrons de raios X (XPS) foi realizada em um espectrômetro de fotoelétrons de raios X ESCALAB 250XI (Thermo Fisher Scientific, EUA). A área de superfície específica e a distribuição do tamanho dos poros das amostras foram determinadas por análise de adsorção-dessorção de nitrogênio.
Adsorção estática de polissulfetos
Normalmente, uma solução de Li2S6 de 0,003 mol/L foi obtida pela reação estequiométrica de Li2S e S em 1,2-dimetoxietano (DME) e 1,3-dioxolano (DOL) (1: 1 em volume) a 60 ℃ por 24 h. Em seguida, 10 mg de Co/C-700 ou HEC-700 foram adicionados a 3 mL da solução de polissulfeto de lítio. A fotografia foi tirada após a amostra repousar por 1 h.