Atividade eletroquímica do eletrodo positivo Material da bateria de íon de sódio P2-Nax[Mg0,33Mn0,67]O2
Autor: ZHANG Xiaojun1, LI Jiale1,2, QIU Wujie2,3, YANG Miaosen1, LIU Jianjun2,3,4
1. Centro Científico e Tecnológico da Província de Jilin para Conversão Limpa e Utilização de Biomassa de Alto Valor, Universidade de Energia Elétrica do Nordeste, Jilin 132012, China
2. Laboratório Chave Estadual de Cerâmica de Alto Desempenho e Microestrutura Superfina, Instituto de Cerâmica de Xangai, Academia Chinesa de Ciências, Xangai 200050, China
3. Centro de Ciência de Materiais e Engenharia Optoeletrônica, Universidade da Academia Chinesa de Ciências, Pequim 100049, China
4. Escola de Química e Ciência dos Materiais, Instituto de Estudos Avançados de Hangzhou, Universidade da Academia Chinesa de Ciências, Hangzhou 310024, China
Resumo
Com as vantagens de baixo custo e ampla distribuição de matérias-primas, baterias de íon de sódio são consideradas os melhores materiais alternativos para materiais de cátodo de bateria de íon de lítio. Na fase P2 NaMnO2 com camadas estrutura, a solução sólida binária da camada de metal de transição pode efetivamente melhorar o desempenho eletroquímico do material do eletrodo. Nesta estudo, o modelo estrutural de Nax[Mg0,33Mn0,67]O2 com íon Mg solução sólida foi construída usando o modelo Coulombic. O cálculos de primeiros princípios revelaram que a tensão de descarga de Nax[Mg0,33Mn0,67]O2 atingiu 3,0 V em uma teor de íons de sódio inferior a 0,67. Densidade eletrônica de estados e carga a análise populacional mostrou que a solução sólida de Mg motivou a reação aniônica atividade eletroquímica do oxigênio da rede na fase P2 Nax[Mg0,33Mn0,67]O2, que transformou o mecanismo de reação eletroquímica do sistema de catiônicos e aniônicos reação redox sinérgica para reação redox aniônica reversível. Esse transformação fornece um novo método para o projeto de materiais de eletrodo para baterias de íon Na, bem como uma nova abordagem para a otimização e exploração de outras baterias de íons.
Palavras-chaveï¼ bateria de íon de sódio ; eletroquímico atividade ; primeiro princípio ; dopagem com metais alcalinos
TOB NEW ENERGY fornece um conjunto completo de materiais de bateria, máquina de bateria, solução de linha de produção de bateria e tecnologia de bateria para bateria de estado sólido, Fabricação de bateria de íon de sódio e bateria de íon de lítio.
Berthelot et al.[10]descobriram que no óxido em camadas NaTMO2 contendo um único metal de transição (TM), sódio íons e vagas são ordenados na camada de sódio puro, resultando em muitos plataformas de tensão para este tipo de óxido durante o processo de descarga. . Esse resulta em uma rápida deterioração da capacidade específica e uma redução significativa na desempenho do ciclo, portanto a eficiência de conversão de energia deste tipo de óxido é baixo. Elementos de solução sólida são introduzidos na camada de metal de transição para formam um arranjo misto de metais de transição binários ou mesmo multielementares. O O material do eletrodo contém um grande número de cargas desordenadas, que podem efetivamente suprimir a plataforma de tensão acima e melhorar a conversão de energia eficiência. Yabuuchi et al. [11] usaram Na2CO3, (MgCO3)4Mg(OH)2·5H2O e MnCO3 como matéria-prima. Uma reação no estado sólido foi realizada a 900°C por 12 horas para obter um eletrodo de Na2/3[Mg1/3Mn2/3]O2 de fase P2 binária desordenada material com solução sólida de Mg. Eles descobriram que a uma densidade de corrente de 10 mA/g, a capacidade específica inicial da fase P2 preparada O material do cátodo Na2/3[Mg1/3Mn2/3]O2 era de aproximadamente 150 mAh/g[11]. Um pouco inferior à capacidade específica de Na2/3MnO2 (184 mAh/g). Bruce et al.[12]descobriram que embora houvesse uma reação eletroquímica da rede oxigênio na fase P2 Na2/3[Mg1/3Mn2/3]O2, nenhuma precipitação de oxigênio foi observado. Mostra que a introdução de Mg melhora a reversibilidade do ciclo e capacidade específica reversível do material. Porém, durante a cobrança e processo de descarga, o mecanismo microscópico de reação eletroquímica de o oxigênio da rede neste sistema ainda não está claro, e o mecanismo pelo qual A solução sólida de Mg melhora a estabilidade do sistema também não está clara.
Portanto, este trabalho leva a fase P2 Nax[Mg0.33Mn0.67]O2 como objeto de pesquisa e adota os primeiros princípios método de cálculo da teoria do funcional da densidade (DFT). Um estudo sistemático sobre a atividade eletroquímica e estabilidade estrutural da descarga desempenho do material catódico Nax[Mg0,33Mn0,67]O2 com solução sólida de Mg íons foi conduzido. A fim de esclarecer o mecanismo microscópico do eletrodo materiais em reações eletroquímicas na microescala de elétrons e átomos, fornecerá uma referência para a compreensão da eletroquímica processos e design de novos materiais.
1 Método de cálculo
Os cálculos deste trabalho são baseados em o pacote VASP de software de base de onda plana [13,14] de densidade teoria funcional. O método de onda plana aditiva é usado[15], e o funcional de correlação de troca é a aproximação do gradiente generalizado (GGA) na forma de Perdew-Burker-Ernzerhof[13,16]. O Hubbard o parâmetro U é introduzido para corrigir os elétrons d de Mn, e o U efetivo o valor é 3,9 eV[17,18]. A energia de corte da onda plana inferior é 600 eV. Quando o relaxamento iônico é concluído, as forças sobre todos os átomos são menores que 0,1 eV·nm-1. Ao otimizar a estrutura cristalina, um 3×3×1 (72 átomos) estrutura de supercélula é usada, a constante de rede é 0,874 nm x 0,874 nm x 1,056 nm, e a grade de pontos k da zona de Brillouin é 3 × 3 × 3 [19]. O O método do fônon congelado foi usado para calcular o espectro de vibração da rede em o pacote de software Phonopy. Para evitar a influência de alterações periódicas condições de contorno, uma estrutura de supercélula 3×3×1 foi usada para calcular o constantes de força e espectros de fônons da fase P2 NaMnO2 e Na[Mg0,33Mn0,67]O2. O modelo Coulomb de carga pontual é usado para calcular rapidamente a ocupação iônica da estrutura dessódica, e a configuração de ocupação de Na com menor A energia de Coulomb é selecionada para cálculos de primeiros princípios mais precisos [20]. A tensão de descarga do material do eletrodo pode ser expressa como[20]:
$V=-\frac{G(\text{N}{{\text{a}}_{{{x}_{2}}}}\text{M}{{\text{O} }_{2}})-G(\text{N}{{\text{a}}_{{{x}_ {1}}}}\text{M}{{\text{O}}_{2}})-({{x}_{2}}-{{x}_{1}})G(\ texto{Na})}{({{x}_{2}}-{{x}_{1}}){{e}^{-}}}$
Onde G é a energia total do sistema correspondente, e e- é a carga do elemento[21].
2 Resultados e discussão
2.1 Características microestruturais e estabilidade estrutural
O grupo espacial da fase P2 NaMnO2 estrutura é R$\bar{3}m (Fig. 1)[22,23]. A configuração espacial da solução sólida de Mg, a estrutura Na0,67[Mg0,33Mn0,67]O2 é semelhante à de NaMnO2. Os íons Mg substituem 1/3 dos íons Mn na camada de metal de transição. O a proporção teórica de íons de Mg para Mn é 1:2. Caracterização experimental encontrada que nesta proporção, os íons Mg na estrutura Nax[Mg0,33Mn0,67]O2 apenas se formam arranjos desordenados com Mn, mantendo a ordem da camada de Na[24]. Quando a proporção de íons Mg:Mn1:2, Mg, Na e Mn formarão uma mistura desordenada arranjo de cátions. Conforme mostrado na Figura 1 (A), o modo de empilhamento da rede o oxigênio é ABBA..., Mg e Mn ocupam respectivamente os sítios octaédricos entre as camadas AB de oxigênio, e Na ocupa os locais do prisma triangular entre as camadas de oxigênio AA e BB[25,26]. Conforme mostrado na Figura 1 (B), há um arranjo em favo de mel de Mg e Mn na camada de metal de transição [27], que é semelhante ao arranjo entre Li e Mn em compostos ricos em lítio [28]. O octaedro [MgO6] é organizado com 6 octaedros [MnO6] compartilhando bordas[29,30]. Na camada de metal alcalino do Na estrutura Na0.67[Mg0.33Mn0.67]O2, existem dois locais de rede para íons de sódio. Um está organizado com as camadas superior e inferior de octaedros [MgO6] ou [MnO6] compartilhando bordas. A outra está disposta coplanarmente com as camadas superior e inferior de Octaedros [MgO6] ou [MnO6].
![Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2 Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2](/js/htmledit/kindeditor/attached/20231108/20231108103040_37156.webp)
Fig. 1 Diagrama esquemático de P2-Na2/3[Mg1/3Mn2/3]O2
Em estruturas com diferentes íons de sódio conteúdo, os íons sódio são afetados pela interação Coulomb entre Mn e Mg na camada de metal de transição e íons Na na camada de metal alcalino, mostrando dois modos de ocupação diferentes. Portanto, este trabalho utiliza primeiramente o Coulomb modelo para filtrar rapidamente a configuração Na0.67[Mg0.33Mn0.67]O2 da fase P2 com a menor energia de Coulomb. Para verificar a racionalidade, calculou e simulou os padrões de XRD dessas configurações selecionadas e comparou-os com os resultados medidos [11]. Os resultados são mostrados na Figura 2. Os (016) e (110) calculados estão ligeiramente deslocados para a direita em comparação com a caracterização experimental, que se deve principalmente à existência de estruturas amorfas e defeituosas em alguns planos cristalinos do materiais preparados experimentalmente. A estrutura do modelo computacional é uma estrutura cristalina perfeita, então há um certo desvio entre o XRD ampliação e intensidade de pico da simulação computacional e o resultados experimentais. Além disso, há um arranjo de íons Na nesses dois planos cristalinos, e a inserção e desprendimento de íons Na é outro possível razão para a mudança das posições de pico correspondentes. Depois considerando os efeitos acima, a forma e a intensidade do pico do simulado XRD são consistentes com os resultados experimentais, e o modelo construído pode reproduzir as informações microestruturais do experimento, indicando que a estrutura teoricamente selecionada é relativamente precisa e confiável[31,32].
![Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2 Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103050_54123.webp)
Fig. 2 Comparaçãon de XRD calculado e experimental padrões de Na0,67[Mg0,33Mn0,67]O2
Para estudar o efeito do Mg sólido solução sobre estabilidade estrutural, usamos primeiros princípios combinados com o "método fônon congelado" para calcular os espectros de vibração da rede de P2-NaMnO2 e P2-Na[Mg0,33Mn0,67]O2. Como mostrado na Figura 3, a onda possuidora não tem frequência imaginária em toda a zona de Brillouin, indicando que P2-Na[Mg0,33Mn0,67]O2 possui estabilidade dinâmica. Ao comparar os espectros de fônons de dos dois materiais, descobriu-se que a dopagem com Mg não alterou significativamente a faixa de frequência de vibração e teve pouco impacto na vibração da rede. O A estrutura dopada com Mg também apresentou boa estabilidade dinâmica. Além disso, Bruce e cols. al. preparou com sucesso a fase P2 Na[Mg0,33Mn0,67]O2 com solução sólida de Mg, que demonstrou ainda que o material possui propriedades termodinâmicas adicionais estabilidade. Portanto, não é difícil ver que P2-Na[Mg0,33Mn0,67]O2 tem boa estabilidade estrutural.
![Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2 Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103102_42296.webp)
Fig. 3 Curvas de dispersão de fônons de (A) NaMnO2 e (B) Na0,67[Mg0,33Mn0,67]O2
2.2 Análise de propriedades eletroquímicas da fase P2 Nax[Mg1/3Mn2/3]O2
Para estudar o efeito do doping com Mg nas propriedades eletroquímicas dos materiais, calculamos a descarga tensão da estrutura de solução sólida de Mg P2-Nax[Mg0,33Mn0,67]O2 (Figura 4). O faixa de concentração de íons Na é determinada experimentalmente, ou seja, 0,11â¤xâ¤0,66[11].A Figura 4(A) mostra as mudanças estruturais durante o processo de descarga e sua tensão correspondente (Figura 4 (B)) inclui principalmente três plataformas: 3,4, 2,9 e 2,1 V. A capacidade teórica prevista é 152 mAh/g, o que é basicamente consistente com os resultados experimentais[11]. A curva de tensão de descarga calculada a partir dos primeiros princípios é ligeiramente superior ao resultado real medido. A principal razão é que o primeiro cálculo de princípios ignora a influência da medição experimental condições, como eletrólito, condutividade experimental de íons de lítio temperatura de medição, etc. Nossa pesquisa anterior mostrou[33]que embora a curva de tensão de descarga calculada seja superior à curva medida experimentalmente, a tendência geral de mudança é consistente. Portanto, pode-se considerar que durante todo o processo de alta, o a tensão de Nax[Mg0,33Mn0,67]O2 é consistente com os resultados experimentais[12,20]. Quando x<66%, Nax[Mg0,33Mn0,67]O2 tem uma alta voltagem de cerca de 3,0 V, e não há nenhuma plataforma de voltagem adicional óbvia, indicando que a substituição de Mg2+ por Mn3+ tem o efeito de inibir o rearranjo do íon sódio e mudança de fase estrutural. Estudos anteriores de carga e descarga em NaMnO2 e outros sistemas descobriram que o arranjo ordenado dos metais de transição é geralmente acompanhado por mais plataformas de tensão.
![Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge](/js/htmledit/kindeditor/attached/20231108/20231108103110_90088.webp)
Fig. 4 (A) mudanças estruturais calculadas pela DFT e (B) curva de tensão de descarga de P2-Nax[Mg0,33Mn0,67]O2 durante a descarga
Em circunstâncias ideais, a valência estados de Mg e Mn em Na2/3[Mg0,33Mn0,67]O2 são +2 e +4 respectivamente, e não pode continuar a ser oxidado para estados de valência mais elevados. Portanto, não há atividade eletroquímica de cátions no sistema, e a carga e descarga O processo do material é uma reação eletroquímica de ânion. Em Na0,67MnO2, o estado de valência inicial dos íons Mn é +3,33. Durante o processo de carregamento, Mn os íons podem transferir 0,67 elétrons para fora para atingir uma valência estável de +4. No desta vez, todo o Na+ foi liberado e o oxigênio da rede nunca foi liberado. participou da reação eletroquímica[34]. Portanto, o processo de carga e descarga de Na0.67MnO2 aparece como um catiônico reação eletroquímica. Muitos estudos mostram que quando o número de elétrons perdidos pelo oxigênio da rede é inferior a 0,33, o eletroquímico aniônico a reação tem boa reversibilidade[11-12,28]. A oxidação excessiva de ânions de oxigênio (o número de elétrons perdidos é maior que 0,33) faz com que o configuração eletrônica do oxigênio para se desviar do stregra de oito acopladores, resultando em uma reação de transformação irreversível e na formação de um Ligação O-O. Pode até levar à evolução do oxigênio e à carga irreversível e descarga da estrutura do eletrodo[27,35]. Em Na0,67[Mg0,33Mn0,67]O2, se for considerado o estado limite de perda de carga. Que é, quando os íons Na são completamente separados para formar o Na0[Mg0,33Mn0,67]O2 estrutura, Mg e Mn sempre mantêm valências +2 e +4. O ânion O é oxidado a -1,67 valência, perdendo 0,33 elétrons, o que é inferior ao limite de reação eletroquímica de ânion irreversível. Portanto, em todo creação de carga de Na0,67[Mg0,33Mn0,67]O2, o oxigênio da rede não precisa para ser reorganizado espacialmente, e a reação eletroquímica é reversível. A introdução do Mg2+ não só mantém a capacidade específica reversível, mas também aumenta a densidade de energia do material, aumentando a tensão de descarga.
Para provar a eletroquímica atividade de oxigênio no material Nax[Mg0,33Mn0,67]O2 durante a descarga processo, calculamos a densidade eletrônica de estados (Figura 5) para o estruturas de descarga inicial e final do material. Foi descoberto que durante o processo de descarga, os íons Na foram gradualmente incorporados, o número total de elétrons no sistema aumentou, e o nível de Fermi mudou para um nível mais alto nível de energia. O número de buracos na órbita O2p diminui gradualmente, indicando que os elétrons que entram no sistema são transferidos para o vazio órbitas de oxigênio na rede, e o oxigênio na rede é reduzido. Durante o processo de descarga do material do eletrodo, o oxigênio da rede participa a reação eletroquímica de ânions. Neste momento, quase não há mudança nos elétrons do orbital Mn-d, e não há transferência de carga, ou seja, o o estado de valência do Mn não muda durante o processo de descarga, provando que O Mn não é eletroquimicamente ativo[12,36]. No entanto, durante o processo de descarga de P2-NaxMnO2, os elétrons continuam a preencher o Mn de alta energia e O orbitais vazios, indicando que tanto Mn quanto O são eletroquimicamente ativos e são uma reação eletroquímica típica na qual ânions e cátions cooperam.
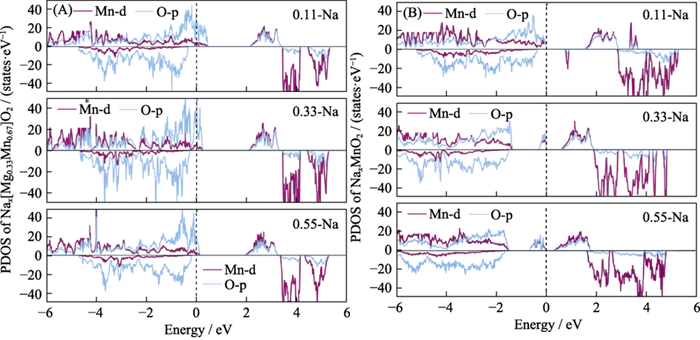
Fig. 5 Densidade eletrônica dos estados de (A) P2-Nax[Mg0,33Mn0,67]O2 e (B) P2-NaxMnO2 sob diferentes íons Na conteúdo durante a alta
PDOS: projetado densidade de estados
Uma conclusão consistente pode ser tirada através da análise da população de cobrança (Figura 6). Durante o processo de alta de Nax[Mg0,33Mn0,67]O2, a quantidade de carga dos íons Mn basicamente não muda, então não participa da reação eletroquímica; no processo de aumentando o teor de Na de 0,11 para 0,66, os íons O obtiveram cerca de 0,2e-. Ocorreu preenchimento significativo de carga, mostrando atividade eletroquímica aniônica [37]. Através da análise populacional de carga de P2-NaxMnO2, foi encontrado que à medida que o teor de Na aumenta, o Mn e o O participam conjuntamente na reação eletroquímica. Este resultado é consistente com a análise de densidade eletrônica de estados. Está provado que a solução sólida de Mg muda o mecanismo de reação eletroquímica do sistema de ânion e reação eletroquímica cooperativa de cátions a um ânion reversível reação eletroquímica, e este processo não afeta a carga e reversibilidade de descarga do material.
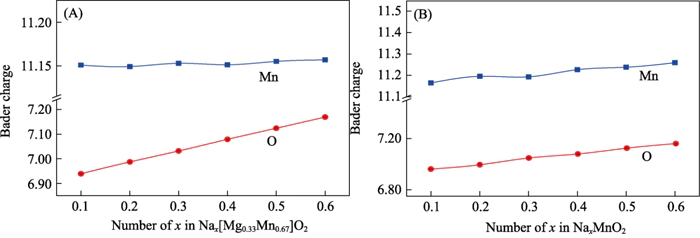
Fig. 6 Cobrança análise de (A) Nax[Mg0,33Mn0,67]O2 e (B) P2-NaxMnO2 sob diferentes íons de sódio conteúdo
3 Conclusão
Este estudo utilizou princípios básicos cálculos para estudar sistematicamente as características microestruturais, estabilidade cinética e atividade eletroquímica da solução sólida Mg2+ P2 fase Nax[Mg1/3Mn2/3]O2. A introdução de Mg2+ altera a eletroquímica tipo de reação do material da cooperativa aniônica e catiônica reação eletroquímica de NaxMnO2 ao eletroquímico aniônico reversível reação de Nax[Mg0,33Mn0,67]O2. Quando o ânion O em P2-Nax[Mg0.33Mn0.67]O2 participa da reação eletroquímica, a faixa de ganho e perda de carga é menos de 0,33, que tem boa reversibilidade. A introdução do Mg2+ não só aumenta a tensão de descarga do material, mas também mantém a capacidade específica reversível do material e, em última análise, aumenta a densidade de energia do material.
Em materiais de eletrodo de íon de sódio, introdução de metais alcalino-terrosos na transição metcamada al para catiônico solução sólida é uma nova estratégia de otimização de desempenho de material. É básico O mecanismo é desencadear a atividade eletroquímica dos ânions sacrificando a atividade eletroquímica dos cátions, alterando a reação eletroquímica mecanismo do material, aumentando a tensão de descarga e, finalmente, otimizando a densidade de energia do material. Esta estratégia não só fornece um novo método para o projeto de materiais de eletrodos para baterias de íon de sódio, mas também fornece novas ideias para a otimização e exploração de outros íons baterias.
Referências
[1] HU YING-YING, WEN ZHAO-YIN, RUI-KUN, et al. Estado da arte status de pesquisa e desenvolvimento de baterias de sódio. Armazenamento de energia Ciência e Tecnologia, 2013,2(2):81-90.
[2] SHEN GUAN-YE, LI CHEN, XU BING-LIANG, et al. Alocação econômica para sistema de armazenamento de energia considerando energia eólica. Jornal do Nordeste Universidade de Energia Elétrica, 2018,38(4):27-34.
[3] MA CHAO, ZHAO XIAO-LIN, KANG LI-TAO, et al. Não conjugado materiais de ânodo dicarboxilato para células eletroquímicas. Angew. Química. Internacional Ed., 2018,57(29):8865-8870.
[4] RICARDOS W D, DACEK S T, KITCHAEV D A, et al. Fluoração de materiais catódicos de óxido de metal de transição com excesso de lítio. Energia Avançada Materiais, 2018,8(5):1701533.
[5] XIANG XING-DE, ZHANG KAI, CHEN JUN. Avanços recentes e perspectivas de materiais catódicos para baterias de íon de sódio. Av. Mater., 2015,27(36):5343-5364.
[6] MA CHAO, ZHAO XIAO-LIN, HARRIS M M, et al. Ácido úrico como composto eletroquimicamente ativo para baterias de íon de sódio: mecanismos escalonados de armazenamento de Na + de conjugação Ï e ânion de carbono estabilizado. Materiais Aplicados ACS & Interfaces, 2017,9(39):33934-33940.
[7]LEE D H, XU JING, MENG Y S. Um cátodo avançado para baterias de íon Na com alta taxa e excelente estabilidade estrutural. Física. Química. Química. Física, 2013,15(9):3304-3312.
[8] KUBOTA K, YABUUCHI N, YOSHIDA H, et al. Óxidos em camadas como materiais de eletrodo positivo para baterias de íon Na. Boletim MRS, 2014,39(5):416-422.
[9] CLÃMENT R J, BRUCE P G, GREY C P. Reviewâmanganês- baseados em óxidos de metais de transição do tipo P2 como materiais catódicos de baterias de íons de sódio. Diário do Sociedade Eletroquímica, 2015,162(14):A2589-A2604.
[10] BERTHELOT R, CARLIER D, DELMAS C. Eletroquímica investigação do diagrama de fases P2-NaxCoO2. Nat. Mater., 2011,10(1):74-80.
[11] YABUUCHI N, HARA R, KUBOTA K, et al. Um novo eletrodo material para baterias recarregáveis de sódio: Na2/3[Mg0,28Mn0,72]O2 tipo P2 com anormalmente alto capacidade reversível. J. Mater. Química. A, 2014,2(40):16851-16855.
[12] MAITRA U, CASA R A, SOMERVILLE J W, et al. Redox de oxigênio química sem excesso de íons de metais alcalinos em Na2/3[Mg0,28Mn0,72]O2. Nat. Química, 2018,10(3):288-295.
[13] GUO SHAO-HUA, SUN YANG, YI JIN, et al. Entendimento difusão de íons de sódio em óxidos P2 e P3 em camadas por meio de experimentos e cálculos de primeiros princípios: uma ponte entre a estrutura cristalina e desempenho eletroquímico. Materiais NPG Ásia, 2016,8:e266.
[14] JI HUI-WEI, KITCHAEV D A, LUN ZHANG-YAN, et al. Computacional investigação e realização experimental de íons de lítio desordenados de alta capacidade cátodos baseados em Ni redox. Química de Materiais, 2019,31(7):2431-2442.
[15] LEE J, URBAN A, LI XIN, et al. Desbloqueando o potencial de óxidos desordenados com cátions para baterias de lítio recarregáveis. Ciência, 2014,343(6170):519-522.
[16] URBAN A, LEE J, CEDER G. A configuração espaço de óxidos do tipo rocksalt para eletrodos de bateria de lítio de alta capacidade. Energia Avançada Materiais, 2014,4(13):1400478.
[17] CHAKRABORTY A, DIXIT M, AURBACH D, et al. Previsão precisa propriedades catódicas de materiais de óxido em camadas usando a densidade SCAN meta-GGA funcional. npj Computacional Materiais, 2018, 4:60.
[18] URBAN A, ABDELLAHI A, DACEK S, et al. Estrutura eletrônica origem da desordem catiônica em óxidos de metais de transição. Física. Lett., 2017,119(17):176402.
[19] ASSAT G, TARASCON J M. Fundamental compreensão e desafios práticos da atividade redox aniônica em íons de lítio baterias. Energia da Natureza, 2018,3(5):373-386.
[20] YABUUCHI N, NAKAYAMA M, TAKEUCHI M, et al. Origem de estabilização e desestabilização na reação redox de estado sólido de íons óxido para baterias de íon de lítio. Nat. Comun., 2016,7:13814.
[21] SANNYAL A, AHN Y, JANG J. Primeiros princípios estudo sobre o siligene bidimensional (2D SiGe) como material anódico de um bateria de íon de metal alcalino. Computacional Ciência de Materiais, 2019,165:121-128.
[22] LI HONG, HU YONG-SHENG, PAN HUI-LIN, et al. Progresso da pesquisa em estrutura do material do eletrodo da bateria de armazenamento de íons de sódio à temperatura ambiente. Ciência Sinica Química, 2014,44(8):1269-1279.
[23] WANG YUE-SHENG, XIAO RUI-JUAN, HU YONG-SHENG, et al. P2-Na0.6[Cr0.6Ti0.4]O2 eletrodo com desordem catiônica para baterias de íon de sódio recarregáveis simétricas de alta taxa. Nat. Comun., 2015,6:6954.
[24] WANG QIN-CHAO, MENG JING-KE, YUE XIN-YANG, et al. Tuning estruturado em P2 material catódico por substituição de Mg no local Na por baterias de íon Na. J. Sou. Química. Soc., 2019,141(2):840-848.
[25] MENDIBOURD A, DELMAS C, HAGENMULLER C. Eletroquímica intercalação e desintercalação de bronzes NaxMnO2. Academic Press, 1985,57(3):323-331.
[26] SOMERVILLE J W, SOBKOWIAK A, TAPIA-RUIZ N, et al. Natureza do Fase “Z” em cátodos de bateria de íons de Na em camadas. Energia e Ciência Ambiental, 2019,12(7):2223-2232.
[27] QU JIE, WANG DONG, YANG ZU-GUANG, et al. Dopagem iônica- ajuste de cátodo composto induzido por variação local: um estudo de caso de camada-túnel Na0,6MnO2 com dopagem com Mg2+ no local de Na/Mn. Aplicativo ACS. Matéria. Interfaces, 2019,11(30):26938-26945.
[28] SATO T, SATO K, ZHAO WEN-WEN, et al. Metaestável e óxidos do tipo rocksalt desordenados com cátions nanométricos: revisitação da estequiometria LiMnO2 e NaMnO2. Diário de Materiais Química A, 2018,6(28):13943-13951.
[29] GUIGNARD M, DELMAS C. Usando uma bateria para sintetizar novos óxidos de vanádio. Seleção de Química, 2017,2(20):5800-5804.
[30] WANG PENG-FEI, YAO HU-RONG, LIU XIN-YU, , et al. A desordem de Na+/vacância promete baterias de íons de Na de alta taxa. Avanços da Ciência, 2018, 4(3): ear6018.
[31] KIM H, KIM D J, SEO D H, et al. Estudo ab initio da intercalação de sódio e fases intermediárias em Na0,44MnO2 para bateria de íons de sódio. Química de Materiais, 2012,24(6):1205-1211.
[32] LI XIN, MA XIAO-HUA, SU DONG, et al. Visualização direta do efeito Jahn-Teller acoplado ao ordenamento do Na em Na5/8MnO2. Nat. Mater., 2014,13(6):586-592.
[33] WANG YOUWEI, WANG JUNKAI, ZHAO XIAOLIN, et al. Reduzindo a cobrança potencial excessivo de baterias de Li-O2 por meio do design do cátodo com alinhamento de banda. Energia e Ciência Ambiental, 2020,13(8):2540-2548.
[34] ZHENG C, RADHAKRISHNAN B, CHU I H, et al. Efeitos de mistura de metais de transição na ordenação de Na e na cinética de óxidos P2 em camadas. Revisão Física Aplicado, 2017,7(6):064003.
[35] LUN ZHENG-YAN, OUYANG B, CAI ZI-JIAN, et al. Princípios de design para cátodos de sal rochoso desordenados com cátions baseados em Mn de alta capacidade. Química, 2020,6(1):153-168.
[36] SEO D H, LEE J, URBAN A, et al. O estrutural e origem química da atividade redox do oxigênio em camadas e desordenadas por cátions Materiais catódicos com excesso de lítio. Nat. Química, 2016,8(7):692-697.
[37] BAI QIANG, YANG LU-FENG, CHEN HAI-LONG, et al. Estudos computacionais de materiais de eletrodo em baterias de íon de sódio. Energia Avançada Materiais, 2018,8(17):1702998.