A degradação da capacidade em baterias de íons de lítio é categorizada em perda de capacidade reversível e perda de capacidade irreversível. A perda de capacidade reversível é relativamente "leve" e pode ser parcialmente recuperada ajustando os protocolos de carga-descarga (por exemplo, otimizando a corrente de carga e os limites de tensão) e melhorando as condições de uso (por exemplo, controle de temperatura/umidade). Em contraste, a perda de capacidade irreversível surge de alterações irreversíveis na bateria, levando à redução permanente da capacidade. De acordo com as normas GB/T 31484-2015 para testes de ciclo de vida: "Durante os testes de ciclo de vida padrão, a capacidade de descarga não deve cair abaixo de 90% da capacidade inicial após 500 ciclos, ou 80% após 1.000 ciclos." Se a bateria apresentar rápido declínio de capacidade dentro dessas faixas de ciclo padrão, ela é classificada como falha por desvanecimento da capacidade, tipicamente envolvendo mecanismos de degradação irreversíveis.
I. Fatores relacionados ao material
1. Degradação estrutural do material catódico
Os materiais catódicos sofrem complexas alterações físicas e químicas durante os ciclos de carga-descarga. Tomando como exemplo o LiMn₂O₄ com estrutura espinélio, sua estrutura se distorce devido ao efeito Jahn-Teller durante os ciclos. Essa distorção se acumula com a repetição dos ciclos e pode, eventualmente, causar a fratura das partículas catódicas. Partículas fraturadas degradam o contato elétrico entre as partículas, dificultando o transporte de elétrons e reduzindo a capacidade. Além disso, transições de fase irreversíveis e desordens estruturais ocorrem em alguns materiais catódicos. Por exemplo, sob alta tensão, certos materiais catódicos passam de estruturas cristalinas estáveis para fases desfavoráveis à intercalação/desintercalação de íons de lítio, impedindo a mobilidade dos íons de lítio e acelerando a perda de capacidade.
2. Crescimento excessivo de SEI nas superfícies do ânodo
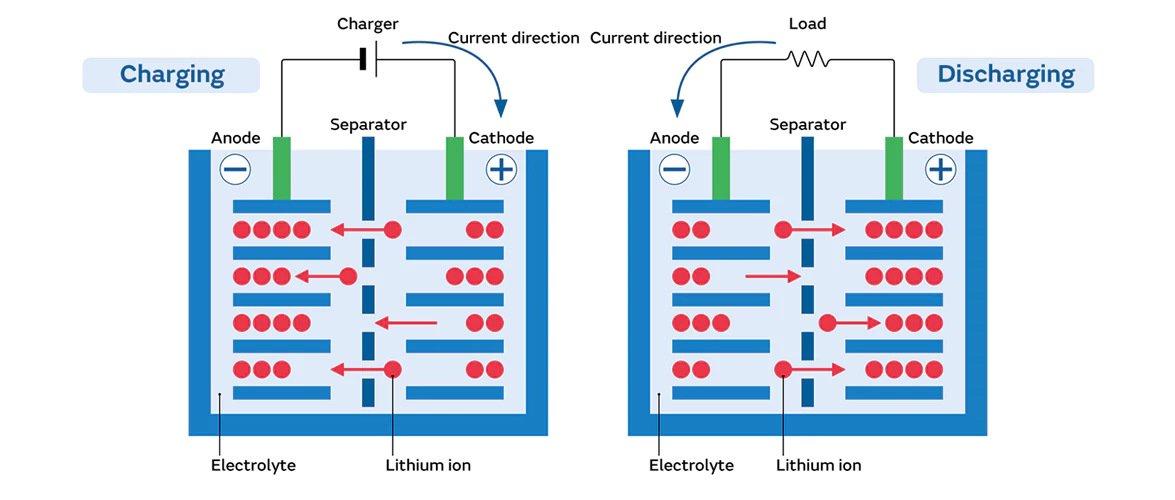
Para ânodos de grafite, as interações entre a superfície e o eletrólito são críticas. Durante o processo de carga inicial, os componentes do eletrólito sofrem reações de redução na superfície do grafite, formando uma camada de interface eletrolítica sólida (IEE). Normalmente, a camada de IEE é ionicamente condutora, mas eletronicamente isolante, protegendo o ânodo da corrosão contínua do eletrólito. No entanto, o crescimento excessivo de IEE apresenta problemas significativos. Primeiro, a formação de IEE consome íons de lítio, reduzindo o Li⁺ disponível para os processos normais de carga-descarga e causando perda de capacidade. Segundo, impurezas de metais de transição (por exemplo, da dissolução do cátodo) depositadas na superfície do ânodo podem catalisar o crescimento adicional de IEE, acelerando a depleção de lítio.
3. Decomposição e degradação de eletrólitos
O eletrólito desempenha um papel vital no transporte de íons. Sais de lítio comuns, como o LiPF₆, apresentam baixa estabilidade química e se decompõem sob altas temperaturas ou tensões, reduzindo o Li⁺ disponível e gerando subprodutos nocivos (por exemplo, PF₅, que reage com solventes). Traços de umidade no eletrólito reagem com o LiPF₆ para produzir ácido fluorídrico (HF), um agente corrosivo que ataca os materiais do cátodo/ânodo e os coletores de corrente. A má vedação da bateria permite a entrada de umidade/oxigênio externo, acelerando a oxidação do eletrólito. Eletrólitos degradados apresentam aumento da viscosidade, descoloração e condutividade iônica drasticamente reduzida, prejudicando gravemente o desempenho da bateria.
4. Corrosão do coletor de corrente
Coletores de corrente (por exemplo, folha de alumínio para cátodos, folha de cobre para ânodos) coletam e conduzem corrente. Falhas incluem corrosão e enfraquecimento da adesão. Os mecanismos de corrosão incluem:
5. Traços de impurezas no sistema da bateria
Impurezas de metais de transição (Fe, Ni, Co) introduzidas por meio de matérias-primas podem participar de reações redox, catalisar a decomposição de eletrólitos ou competir com a intercalação de Li⁺. Essas impurezas também desestabilizam as camadas SEI, exacerbando as reações laterais do ânodo.
II. Fatores Ambientais Operacionais
1. Efeitos da temperatura
• Altas temperaturas aceleram a decomposição de eletrólitos e a reestruturação do SEI. A degradação do LiPF₆ gera PF₅, que reage com solventes, enquanto as camadas do SEI se espessam, formando filmes predominantemente inorgânicos com maior resistência iônica. Por exemplo, veículos elétricos que operam em climas quentes apresentam perda de capacidade acelerada.
2. Taxas de carga-descarga (C-Rates)
Altas taxas C durante o carregamento causam deposição irregular de lítio, formando dendritos que consomem Li⁺ e correm o risco de curtos-circuitos internos. A descarga em alta taxa exacerba a polarização, reduzindo a energia utilizável e acelerando a perda de capacidade. Ferramentas elétricas que exigem descargas frequentes de alta corrente apresentam vida útil da bateria reduzida.
3. Sobrecarga/Descarga excessiva
• A sobrecarga força a desintegração excessiva dos cátodos, causando colapso estrutural e oxidação violenta do eletrólito (geração de gás, inchaço ou fuga térmica).• A descarga excessiva litia os ânodos, desestabilizando sua estrutura e induzindo a redução do eletrólito. Os primeiros smartphones sem circuitos de proteção apresentavam rápida perda de capacidade sob esse tipo de abuso.
Consequências da falha da bateria
A degradação grave da capacidade se manifesta como tempo de execução insuficiente (por exemplo, operação curta do dispositivo após o carregamento) ou comportamento anormal de carregamento (por exemplo, carregamento lento). Em aplicações críticas:
• Veículos elétricos: falha da bateria reduz a autonomia de condução e pode deixar os veículos parados.• Armazenamento de energia em escala de rede: baterias com defeito desestabilizam a confiabilidade do fornecimento de energia, ameaçando a segurança da rede.