WANG Kunpeng, 1, LIU Zhaolin2, LIN Cunsheng2, WANG Zhiyu, 1,2
1. Laboratório Chave Estadual de Química Fina, Escola de Engenharia Química, Universidade de Tecnologia de Dalian, Dalian 116024, China
2. Filial de Desenvolvimento de Novos Materiais, Valiant Co., Ltd., Yantai 265503, China
Resumo
Em comparação com as baterias de íon-lítio, as baterias de íon-Na oferecem os benefícios de baixo custo, bom desempenho em baixas temperaturas e segurança, atraindo grande atenção nas aplicações sensíveis ao custo e à confiabilidade. Com alta capacidade e baixo custo, os materiais semelhantes ao azul da Prússia (PBAs) permanecem como materiais catódicos promissores para baterias de íon-Na. No entanto, a presença de água cristalina dentro da sua estrutura induz uma rápida deterioração do desempenho da bateria, servindo como um gargalo crítico que limita a sua aplicação. Este trabalho relata uma estratégia fácil de tratamento térmico para remover efetivamente a água cristalina dos materiais catódicos dos PBAs, melhorando a retenção da capacidade de 73% para 88% após 340 ciclos. A análise in-situ revela que a perda inicial de eficiência coulombiana do cátodo dos PBAs é resultado de sua transformação irreversível da forma trigonal para a fase cúbica durante o processo de carga e descarga. Este problema pode ser resolvido com a introdução de Na2C2O4 para compensar a perda irreversível de Na no cátodo. Com base nisso, uma bateria de íons de Na de estado quase sólido de alto desempenho é construída combinando um cátodo de PBAs com baixo teor de água com aditivo Na2C2O4 e um ânodo de carbono duro (HC) dentro de um diacrilato de poli(etilenoglicol) (PEGDA ) eletrólito de estado quase sólido baseado em alta condutividade iônica e estabilidade eletroquímica. Esta bateria apresenta capacidades específicas que variam de 58 a 105 mAh·g-1 em densidades de corrente de 20 a 500 mA·g-1, capaz de sustentar ciclos estáveis por mais de 200 ciclos. Este estudo ressalta a melhoria significativa na estabilidade e capacidade dos materiais catódicos de PBAs pela remoção eficiente de água cristalina neles. Palavras-chave: bateria de íons de Na; bateria quase de estado sólido; cátodo azul da Prússia; análise in situ
O desenvolvimento de tecnologia de baterias de alto desempenho é uma importante necessidade estratégica para a China transformar e atualizar sua estrutura energética, promover uma economia limpa de baixo carbono e atingir a meta de "neutralidade de carbono e pico de carbono". As baterias de íons de lítio são um dos sistemas de baterias de alta eficiência mais amplamente utilizados. No entanto, a abundância de lítio na crosta terrestre é de apenas 0,0065%, as reservas de recursos de lítio da China representam apenas 7% do total mundial e quase 70% do carbonato de lítio é importado. Será difícil atender à enorme demanda na área de armazenamento de energia e baterias de energia no futuro. A abundância de sódio na crosta terrestre é mais de 400 vezes maior que a do lítio. As reservas de sódio da China representam cerca de 22% das reservas totais mundiais. Do ponto de vista dos custos das matérias-primas, o custo das baterias de íon de sódio pode ser reduzido em 30% a 40% em comparação com as baterias de íon de lítio. Além disso, em comparação com as baterias de íon de lítio, as baterias de íon de sódio têm melhor desempenho em baixas temperaturas, uma faixa de temperatura operacional mais ampla e maior segurança. Essas vantagens exclusivas os tornaram um foco de atenção em aplicações de armazenamento de energia sensíveis ao custo e críticas para a segurança [1].
Impulsionada pela meta de "duplo carbono", a demanda da China por armazenamento de energia e baterias de energia atingiu 158,5 GWh em 2020, e a demanda mundial por baterias deverá entrar na era TWh em 2025. Com o avanço da tecnologia de baterias, a densidade de energia de As baterias aumentaram rapidamente e os requisitos de segurança das baterias tornaram-se cada vez mais proeminentes. As baterias tradicionais de íon de lítio/sódio usam eletrólitos orgânicos líquidos que são propensos a vazamentos, o que reduz a confiabilidade da bateria [2-3]. O uso de baterias de estado sólido com alta estabilidade termoelétrica, alta resistência mecânica e sem risco de vazamento é uma direção viável para resolver o problema de confiabilidade [4-5], mas apresenta problemas como alta densidade de eletrólitos sólidos, baixa condutividade iônica , e mau contato com a interface "sólido-sólido" dos eletrodos [6]. Eletrólitos quase sólidos entre líquido e sólido têm melhor estabilidade e segurança do que eletrólitos líquidos e são superiores aos eletrólitos sólidos em termos de condutividade iônica, flexibilidade e compatibilidade de interface [7-9]. Essas vantagens tornam as baterias de estado quase sólido baseadas nelas uma das direções de foco mais viáveis no campo da tecnologia avançada de baterias.
Os compostos de azul da Prússia (PBAs) são atualmente os materiais catódicos mais populares para baterias de íons de sódio. Sua estrutura de esqueleto aberto e abundantes locais de armazenamento de sódio conferem-lhes uma alta capacidade específica teórica (170 mAh g-1) e bom desempenho de transporte de íons [10-11]. Em baterias de estado sólido, os PBAs podem ser usados não apenas como materiais catódicos, mas também como eletrólitos sólidos [12-13]. No entanto, os PBAs são geralmente preparados por precipitação em solução, o que formará defeitos de vacância de Fe(CN)64- e uma grande quantidade de água cristalina em sua estrutura, dificultando a incorporação de Na+ na rede dos PBAs e limitando sua capacidade de armazenamento de sódio. Além disso, a água cristalina nos PBAs será gradualmente liberada no eletrólito durante a reação da bateria, levando à rápida deterioração do desempenho da bateria, reações colaterais, flatulência e outros problemas [11,14]. Esses problemas limitam a aplicação de PBAs em baterias de estado sólido e tornam difícil combiná-los com a maioria dos eletrólitos sólidos inorgânicos sensíveis à água. A formação de defeitos de vacância e água cristalina em PBAs pode ser efetivamente inibida por estratégias como tratamento hidrotérmico[15], coprecipitação lenta[16], inibição da oxidação de Fe2+[17], ataque químico[18] e dopagem de elementos[19- 20]. No entanto, os processos técnicos relevantes são complexos e difíceis de controlar com precisão, e o desempenho dos cátodos dos PBA obtidos também precisa de ser melhorado. Diante dos problemas acima, este estudo propõe um método de tratamento térmico simples e eficiente para reduzir o teor de água cristalina em PBAs e melhorar sua estabilidade de armazenamento de sódio. Através da tecnologia de polimerização in-situ, foi desenvolvido um eletrólito sólido de referência de diacrilato de polietilenoglicol (PEGDA) com alta condutividade iônica e alta estabilidade eletroquímica. Com base nisso, o cátodo de PBAs com baixo teor de água e o ânodo de carbono duro (HC) foram combinados no eletrólito sólido de referência PEGDA, e Na2C2O4 foi adicionado ao cátodo como um compensador de sódio auto-sacrificial para construir um quase- bateria de íon de sódio de estado sólido. O mecanismo dinâmico de armazenamento de sódio do cátodo dos PBAs e do ânodo HC foi revelado pela tecnologia de análise in-situ.
1 Método experimental
1.1 Preparação de cátodo de PBAs com baixo teor de água
116 mmol de citrato de sódio e 24 mmol de FeSO4·7H2O foram dissolvidos em 400 mL de água desionizada desoxigenada. 116 mmol de citrato de sódio e 26 mmol de Na4Fe(CN)6 foram dissolvidos em 400 mL de água deionizada desoxigenada. A solução contendo FeSO4 foi adicionada lentamente à solução contendo Na4Fe(CN)6, e a reação foi agitada a temperatura constante durante 6 h. O produto foi lavado três vezes por centrifugação com etanol e água deionizada desoxigenada e seco em vácuo a 120°C por 24 h para obter PBAs com alto teor de água cristalina (Hw-PBAs). Ele foi colocado em um forno tubular protegido com argônio e calcinado a 270°C por 2 h para obter PBAs com baixo teor de água (Lw-PBAs), com uma taxa de aquecimento de 0,5°C·min-1.
1.2 Caracterização da amostra
A morfologia e estrutura da amostra foram analisadas utilizando um microscópio eletrônico de varredura de emissão de campo. A composição química da amostra foi analisada utilizando um espectrômetro fotoelétron de raios X e um espectrômetro de emissão de plasma acoplado indutivamente. A bateria foi analisada in situ usando um difratômetro de raios X de pó e espectroscopia Raman a laser. O teor de água cristalina da amostra foi analisado usando um analisador termogravimétrico em atmosfera de argônio a uma taxa de aquecimento de 10 â·min-1.
1.3 Montagem da bateria e testes de desempenho eletroquímico
1.3.1 Conjunto de meia bateria de íon de sódio líquido
Células-botão CR2016 foram montadas para teste. Material catódico azul da Prússia (Hw-PBAs ou Lw-PBAs), Ketjen black (KB) e aglutinante de fluoreto de polivinilideno (PVDF) foram misturados uniformemente em uma proporção de massa de 8:1:1, N-metilpirrolidona (NMP) foi adicionada como um solvente e dispersante, e a pasta resultante foi revestida uniformemente em folha de alumínio revestida de carbono como cátodo, com uma carga de material ativo de 3~4 mg·cm-2. Folhas metálicas de sódio foram utilizadas como contra-eletrodos e eletrodos de referência. O eletrólito foi uma solução DMC/EC (DMC: carbonato de dimetila, EC: carbonato de etileno, proporção em volume 1:1) de NaClO4 1,0 mol.L-1 e 5,0% de carbonato de fluoroetileno (FEC). A bateria foi montada em um porta-luvas cheio de argônio (teor de água <10-7, teor de oxigênio <10-7).
1.3.2 Conjunto completo de bateria de íon de sódio líquido
O eletrodo positivo foi preparado usando o método acima, HC foi usado como eletrodo negativo e a relação N/P dos eletrodos positivo e negativo foi controlada em 1,1 ~ 1,2. A bateria foi montada em um porta-luvas cheio de argônio (teor de água <10-7, teor de oxigênio <10-7) usando o eletrólito acima.
1.3.3 Preparação de eletrólito quase sólido
PEGDA foi misturado com o eletrólito líquido acima em uma proporção de massa de 7:93. 5,0% de azobisisobutironitrila (AIBN) foi adicionado como iniciador de polimerização para formar uma solução precursora de eletrólito quase sólido. Esta solução foi aquecida a 60°C durante 10 h para formar um eletrólito quase sólido.
1.3.4 Montagem de bateria completa de íon de sódio de estado quase sólido
O material do eletrodo positivo, suplemento de sódio Na2C2O4, agente condutor KB e ligante PVDF foram misturados uniformemente em uma proporção de massa de 6,4: 1,6: 1,0: 1,0, NMP foi adicionado como solvente e dispersante, e a pasta obtida foi revestida uniformemente em um carbono -folha de alumínio revestida como eletrodo positivo, com uma carga de material ativo de 3~4 mg·cm-2. HC foi usado como eletrodo negativo, e a relação N/P do eletrodo positivo e negativo foi controlada em 1,1 ~ 1,2. A solução precursora do eletrólito quase sólido foi adicionada à bateria e, depois que a bateria foi encapsulada, ela foi aquecida a 60 ° C por 10 horas para obter uma bateria quase sólida. A bateria foi montada em um porta-luvas cheio de argônio (teor de água <10-7, teor de oxigênio <10-7).
1.3.5 Teste de desempenho da bateria
A condutividade iônica do eletrólito quase sólido foi testada por espectroscopia de impedância eletroquímica (EIS) usando uma estação de trabalho eletroquímica. A faixa de frequência de teste foi de 1 Hz ~ 1000 kHz e a amplitude da tensão de perturbação foi de 5,0 mV. A janela de estabilidade eletroquímica do eletrólito quase sólido foi testada por voltametria de varredura linear (LSV) com taxa de varredura de 5 mV·s-1. O material e o desempenho da bateria foram estudados pelo método de carga e descarga de corrente constante usando um testador de bateria Land CT2001A. A janela de tensão de meia célula foi de 2,0~3,8 V (vs. Na/Na+), a janela de tensão de célula completa foi de 1,5~3,8 V e a densidade de corrente foi de 10~500 mA·g-1. Ao testar a estabilidade do ciclo, a bateria foi primeiro ciclada 5 vezes a uma densidade de corrente de 50 mA·g-1 e, em seguida, o teste de estabilidade do ciclo foi realizado em diferentes densidades de corrente.
2 Resultados e Discussão
2.1 Análise de morfologia e composição
A curva TGA de Hw-PBAs na Figura 1(a) mostra duas regiões de rápida perda de peso: 1) temperatura ambiente até 270°C, 2) 440 a 580°C. Na primeira região, a perda de peso desde a temperatura ambiente até 120°C (fracção de massa 3,1%) é causada pela remoção de água adsorvida; a perda de peso de 120 a 200°C (fração de massa 6,10%) é causada pela remoção de água intersticial na estrutura estrutural dos PBAs; a perda de peso de 200 a 270°C (fração de massa 6,89%) corresponde à remoção de água cristalina em PBAs. Portanto, foi seleccionado tratamento térmico a 270°C para remover água dos Hw-PBAs. Após tratamento térmico a esta temperatura, os Lw-PBAs obtidos perderam apenas cerca de 1,18% do seu peso à temperatura ambiente ~270°C, que foi 92,67% inferior à dos Hw-PBAs; e perderam cerca de 0,74% do seu peso a 200~270°C, o que foi 89,26% inferior ao dos Hw-PBAs. Os resultados acima mostram que o tratamento térmico pode remover efetivamente diferentes tipos de água nos PBAs, e os PBAs com baixo teor de água obtidos têm boa estabilidade térmica.
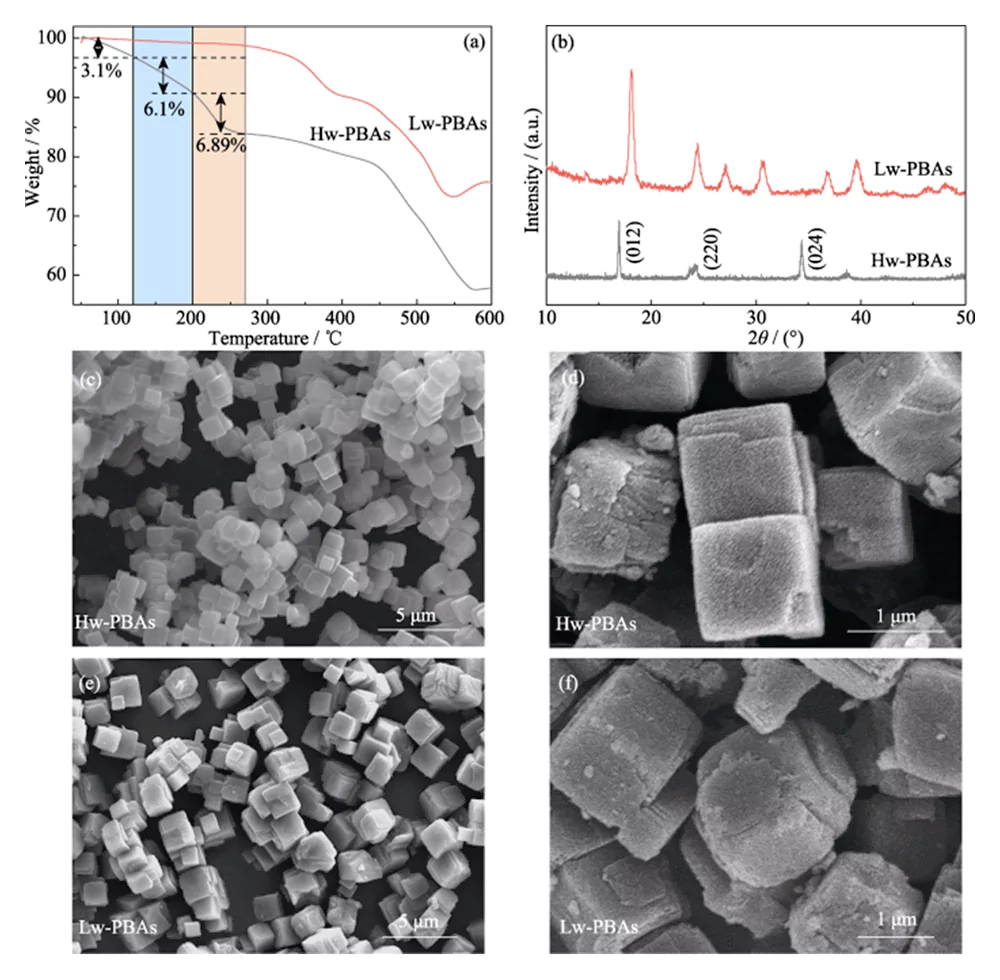
Fig. 1 TGA, análises de morfologia e estrutura do cátodo de PBAs
(a) curvas TGA e (b) padrões de XRD de Hw-PBAs e Lw-PBAs; (cf) Imagens SEM de (c, d) Hw-PBAs e (e, f) Lw-PBAs
A Figura 1 (b) mostra os espectros de XRD de Hw-PBAs e Lw-PBAs. Os picos de difração de Hw-PBAs em 2θ = 17,0°, 24,0° e 34,4° correspondem aos planos cristalinos (012), (220) e (024), respectivamente. Após o tratamento térmico, o pico de difração correspondente ao plano cristalino (024) desaparece, indicando que a água cristalina foi removida com sucesso, e as posições do pico de difração correspondentes aos planos cristalinos (012) e (220) movem-se para ângulos mais elevados, indicando que o volume da célula unitária diminui depois que a água cristalina é removida. Além disso, novos picos de difração aparecem em 2Î1=27,1°, 30,7° e 36,9°, indicando que uma estrutura cristalina trigonal é formada após tratamento térmico. A análise SEM (Figura 1 (c ~ e)) mostra que os Hw-PBAs e os Lw-PBAs têm morfologias cúbicas semelhantes com um tamanho médio de 2 ~ 3 µm. A superfície das partículas de Lw-PBAs obtidas após o tratamento térmico é ligeiramente áspera (Figura 1 (f)), mas devido à baixa temperatura do tratamento térmico, não ocorreu fusão e aglomeração óbvias. A composição dos Lw-PBAs foi estimada em Na1.91Fe-[Fe(CN)6]·3.2H2O analisando o conteúdo do elemento metálico por ICP-OES e medindo o conteúdo de água por TGA.Para explorar ainda mais a composição química e a estrutura dos Hw-PBAs e Lw-PBAs, foi realizada a análise XPS. No espectro Fe2p XPS de alta resolução de Hw-PBAs, os dois picos característicos nas energias de ligação de 708,6 e 721,4 eV correspondem a Fe(II) e Fe(III), respectivamente (Figura 2 (a)). Fe (II) e Fe (III) também existem em Lw-PBAs, mas a proporção de Fe (III) aumenta significativamente (Figura 2 (b)). Isso ocorre porque [NaH2O]+ é removido da estrutura dos PBAs durante o processo de tratamento térmico, e o Fe(II) nos Lw-PBAs é parcialmente oxidado para manter o equilíbrio de valência. No espectro XPS O1s de alta resolução de Hw-PBAs, os picos característicos nas energias de ligação de 536,0, 533,7, 531,9 e 529,7 eV correspondem a água intersticial, água coordenada, grupos hidroxila de superfície e espécies de oxigênio na rede de PBAs, respectivamente (Figura 2(c)). Após o tratamento térmico, o pico característico correspondente à água coordenada desaparece, indicando que este processo pode efetivamente remover a água coordenada dos Lw-PBAs (Figura 2 (d)). Durante este processo, o Fe na superfície dos PBAs reage com grupos hidroxila para formar óxidos de ferro, fazendo com que o pico característico de Fe-O na energia de ligação de 530,0 eV seja bastante aumentado.
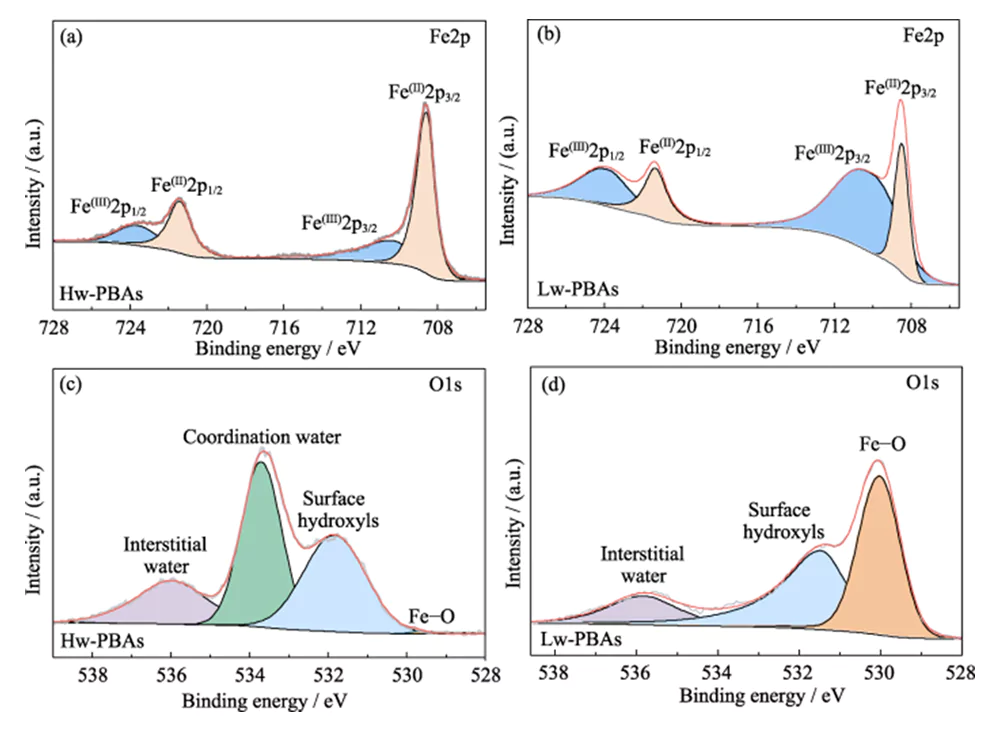
Fig. 2 Composição química do cátodo de PBAs
(a, b) espectros Fe2p XPS de (a) Hw-PBAs e (b) Lw-PBAs; (c, d) espectros XPS O1s de (c) Hw-PBAs e (d) Lw-PBAs
2.2 Desempenho eletroquímico
A Figura 3 (a) mostra as curvas do ciclo de carga-descarga de corrente constante de meias-células de íons de sódio com Hw-PBAs e Lw-PBAs como eletrodos positivos a uma densidade de corrente de 100 mA·g-1, com uma janela de tensão de 2,0~ 3,8 V (vs. Na/Na+). Após 340 ciclos de carga-descarga, o eletrodo positivo Lw-PBAs ainda pode manter uma alta capacidade específica de 91 mAh·g-1, com uma taxa de retenção de capacidade de 88% e uma taxa média de perda de capacidade de carga-descarga única de apenas 0,035 %, apresentando excelente estabilidade do ciclo. Sob as mesmas condições de carga-descarga, a taxa de retenção de capacidade do eletrodo positivo Hw-PBAs sem a remoção de água cristalina é de apenas 73%, mostrando o importante papel da remoção de água cristalina na melhoria da estabilidade do ciclo do eletrodo positivo de PBAs. A Figura 3 (b) mostra a curva de carga-descarga de corrente constante do cátodo Lw-PBAs a uma densidade de corrente de 100 mA·g-1, mostrando uma característica típica da plataforma de dupla tensão: (1) A plataforma de tensão de cerca de 3,2 V corresponde ao processo redox de Fe2+/Fe3+ de baixo spin (coordenado com C); (2) A plataforma de tensão de cerca de 2,9 V corresponde ao processo redox de Fe2+/Fe3+ de alto spin (coordenado com N). O aparecimento de uma plataforma de tensão em cerca de 3,2 V indica que a remoção de água cristalina é benéfica para fortalecer a reação redox de Fe2+/Fe3+ de baixa rotação em PBAs, o que ajuda a melhorar sua capacidade de armazenamento de sódio. No processo de ciclo subsequente, a curva carga-descarga do cátodo Lw-PBAs permaneceu basicamente consistente, mostrando boa estabilidade estrutural. Em densidades de corrente de 10, 50, 100, 200 e 500 mA·g-1, o cátodo Lw-PBAs pode manter altas capacidades específicas reversíveis de 126, 112, 110, 108 e 107 mAh·g-1 (Figura 3 (c)). Em particular, a uma densidade de corrente elevada de 500 mA·g-1, o cátodo Lw-PBAs tem excelente capacidade de retenção e a sua capacidade específica é cerca de 13,4% superior à dos Hw-PBAs. Quando a densidade de corrente cai para 10 mA·g-1, a capacidade específica do cátodo Lw-PBAs pode ser restaurada para 125 mAh·g-1, o que está próximo da capacidade específica inicial, indicando que pode manter excelente estrutura estabilidade durante o armazenamento rápido de sódio.
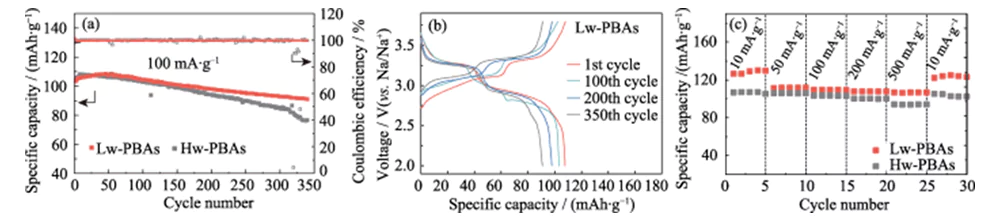
Fig. 3 Desempenho eletroquímico do cátodo de PBAs em meia célula de íon Na
(a) Desempenho de ciclagem de cátodos Lw-PBAs e Hw-PBAs a uma densidade de corrente de 100 mA·g-1; (b) Curvas de carga-descarga do cátodo Lw-PBAs a 100 mA·g-1; (c) Capacidade de taxa de cátodos Lw-PBAs e Hw-PBAs em várias densidades de corrente de 10 mA·g-1 a 500 mA·g-1; A janela de tensão é de 2,0-3,8 V (vs. Na/Na+) para todos os testes de meia célula; Figuras coloridas estão disponíveis no site
2.3 Análise in-situ do mecanismo de armazenamento de sódio
O eletrodo positivo Lw-PBAs foi combinado com o eletrodo negativo HC, e uma solução DMC/EC contendo 1,0 mol·L-1 NaClO4 e 5,0% FEC em massa foi usada como eletrólito líquido (LE) para montar uma bateria completa (Lw -PBAs|LE|HC, Figura 4(a)). As mudanças estruturais dinâmicas dos materiais dos eletrodos positivos e negativos da bateria completa durante as reações de carga e descarga foram estudadas usando tecnologia de análise in-situ. A análise XRD in-situ do eletrodo positivo Lw-PBAs mostrou que após a tensão de carga ter sido aumentada para 3,2 V, os picos de difração correspondentes a (110) e (104) fundiram-se gradualmente para formar um pico amplo (Figura 4 (b) ). Este fenômeno corresponde ao processo de escape do Na+ do eletrodo positivo do Lw-PBAs, fazendo com que sua estrutura cristalina mude de uma estrutura trigonal para uma estrutura cúbica [21]. Durante o processo de descarga, não foi observada nenhuma nova divisão deste pico amplo em picos de difração (110) e (104), indicando que o processo de mudança de fase é irreversível, resultando na primeira perda de eficiência coulombiana. Além disso, durante o primeiro processo de carga e descarga do eletrodo negativo HC, o filme de interfase de eletrólito sólido (SEI) formado na superfície leva à perda irreversível de lítio (18%), o que também é uma das razões para a primeira eficiência coulombiana perda de toda a bateria (Figura 4 (c, d)).
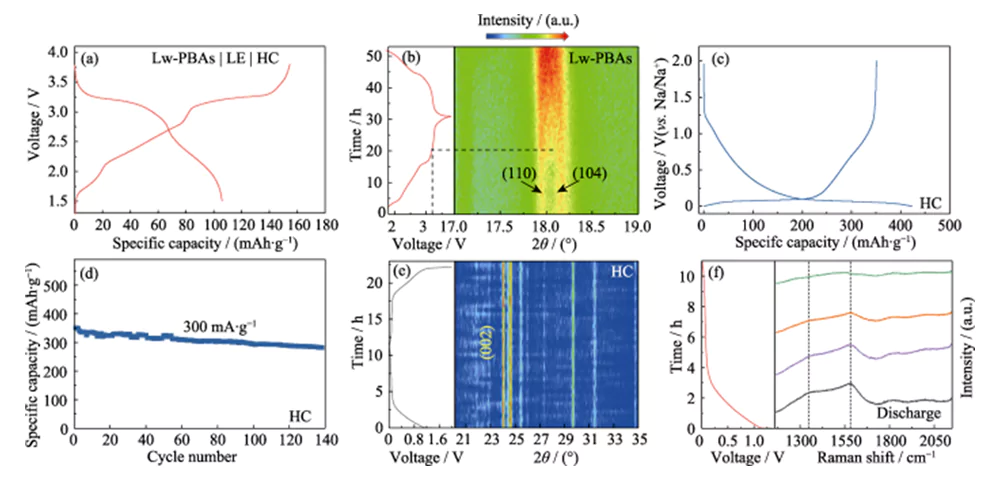
Fig. 4 Análise in-situ do mecanismo de armazenamento de Na para cátodo Lw-PBAs e ânodo HC
(a) Curvas de carga-descarga de célula completa Lw-PBAs|LE|HC; (b) Padrão de XRD in-situ do cátodo Lw-PBAs durante a operação de célula completa; (c) Curvas de carga-descarga para o primeiro ciclo e (d) estabilidade de ciclagem do ânodo HC a uma densidade de corrente de 300 mA·g-1; (e) padrão de XRD in-situ e (f) espectros Raman in-situ do ânodo HC durante a operação de célula completa; Figuras coloridas estão disponíveis no site
No espectro de XRD in-situ do ânodo HC, nenhum deslocamento de pico óbvio (002) foi observado durante o processo de carga e descarga, indicando que o Na+ não foi inserido nas camadas estruturais grafitadas, e nenhum pico de difração do metal sódio foi observado ( Figura 4(e)). Portanto, a capacidade de armazenamento de sódio do ânodo HC pode ser devida à adsorção e preenchimento de Na+ nos ricos locais de defeitos e poros do HC, em vez da intercalação de Na+ ou precipitação de sódio metálico [22]. A fim de estudar ainda mais o mecanismo de reação de armazenamento de sódio no HC, a análise Raman in-situ foi realizada no eletrodo negativo do HC durante o processo de carga e descarga (Figura 4 (f)). O eletrodo negativo HC tem picos característicos Raman óbvios em 1350 e 1594 cm-1. O pico característico com número de onda de 1350 cm-1 corresponde à vibração de estiramento da configuração do carbono aromático (modo G), e o pico característico com número de onda de 1594 cm-1 corresponde à estrutura defeituosa desordenada do carbono (modo D). A relação de intensidade do modo D e do modo G (ID/IG) pode ser usada para medir o grau de defeitos e desordem dos materiais de carbono. Durante o processo de descarga, o ID/IG do ânodo HC diminuiu com a intercalação contínua de Na+, indicando que o comportamento significativo de adsorção de Na+ em seus locais de defeito é a principal fonte da capacidade de armazenamento de sódio do ânodo HC.
2.4 Construção e desempenho de célula completa de estado quase sólido
A primeira eficiência coulombiana da célula completa de íons de sódio construída usando eletrodo positivo Lw-PBAs e eletrodo negativo HC é de apenas 67,3% (Figura 4 (a)). Para resolver esse problema, Na2C2O4 ecologicamente correto, pouco tóxico e estável ao ar é usado como um compensador de sódio auto-sacrificial no eletrodo positivo Lw-PBAs para melhorar a primeira eficiência coulombiana da célula completa [23]. O tamanho de partícula do Na2C2O4 comercial é superior a centenas de mícrons e possui baixa atividade eletroquímica. Portanto, é recristalizado para obter Na2C2O4 com tamanho de partícula de vários mícrons (Figura 5 (a)). O Na2C2O4 de tamanho mícron pode liberar uma alta capacidade específica de 407 mAh · g · 1 durante o primeiro processo de carga dentro da janela de tensão de 2,0 ~ 4,2 V, compensando efetivamente a primeira perda irreversível de capacidade do eletrodo positivo (Figura 5 (b )). A capacidade específica de descarga inicial da célula completa Lw-PBAs|LE|HC com adição de Na2C2O4 (fração mássica 20%) pode chegar a 158 mAh·g-1, o que é 92,7% superior à da célula completa sem adição de Na2C2O4 (Figura 5 (c)). A célula completa Lw-PBAs|LE|HC com adição de Na2C2O4 pode manter uma capacidade específica reversível de 110, 101, 92, 87 e 80 mAh·g-1 em densidades de corrente de 10, 50, 100, 200 e 500 mA ·g-1 (Figura 5(d)). Em uma alta densidade de corrente de 500 mA·g-1, após 1400 ciclos estáveis, a célula completa Lw-PBAs|LE|HC com adição de Na2C2O4 pode manter uma capacidade específica de 64 mAh·g-1, que é 25,4% superior ao da célula completa sem a adição de Na2C2O4 (Figura 5(e)).
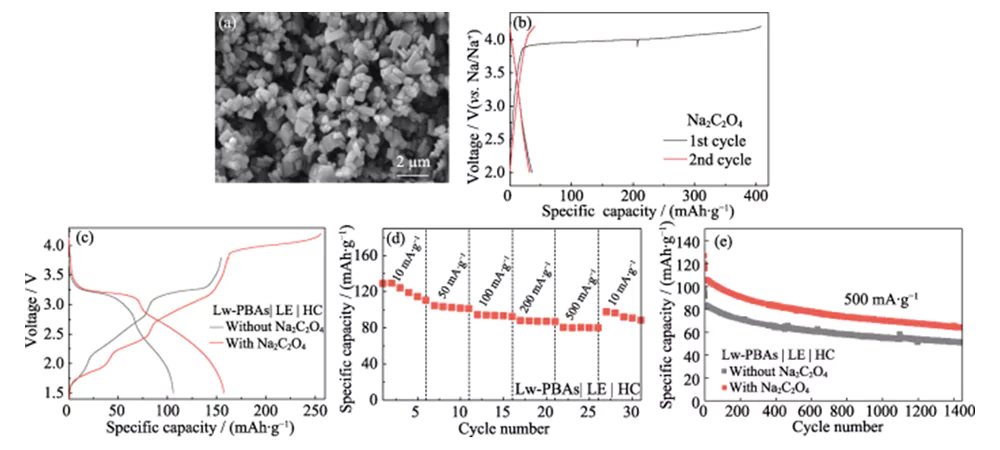
Fig. 5 Efeito do Na2C2O4 no desempenho eletroquímico do cátodo Lw-PBAs
(a) imagem SEM e (b) curvas de carga-descarga de Na2C2O4 com tamanho micrométrico a uma densidade de corrente de 180 mA·g-1; (c) Curvas carga-descarga de células completas Lw-PBAs|LE|HC com ou sem adoção de Na2C2O4 a uma densidade de corrente de 100 mA·g-1; (d) Taxa de desempenho de célula completa Lw-PBAs|LE|HC com Na2C2O4 em várias densidades de corrente de 10 a 500 mA·g-1; (e) Estabilidade de ciclagem de célula completa Lw-PBAs|LE|HC com ou sem uso de Na2C2O4 em grande densidade de corrente de 500 mA·g-1; A janela de tensão é de 1,5 a 3,8 V para todos os testes de célula completa; Figuras coloridas estão disponíveis no site
Nesta base, PEGDA foi misturado com NaClO4 1,0 mol·L-1 e eletrólito DMC/EC com uma fração de massa de 5,0% FEC, e AIBN foi usado como iniciador de polimerização térmica para desenvolver um eletrólito quase sólido de alto desempenho (GPE ). Comparado ao LE, o GPE tem as vantagens de ser menos sujeito a vazamentos e de baixa volatilidade. Pode permanecer estável em alta tensão de 4,9 V (vs. Na/Na+) e possui uma ampla janela de estabilidade eletroquímica (Figura 6 (a)). Comparado com eletrólitos sólidos, o GPE possui maior condutividade iônica e compatibilidade de interface, e a condutividade iônica à temperatura ambiente é de 3,51 mS·cm-1 (Figura 6 (b)). Ele foi ainda combinado com o eletrodo positivo Lw-PBAs de baixo teor de água e o eletrodo negativo HC para construir uma bateria completa de íons de sódio de estado quase sólido (Lw-PBAs | GPE | HC). A uma densidade de corrente de 100 mA·g-1, a capacidade específica de primeira descarga da bateria de estado quase sólido Lw-PBAs|GPE|HC atingiu 147,8 mAh·g-1 (Figura 6(c)). Nas densidades de corrente de 20, 50, 100, 200 e 500 mA·g-1, as capacidades específicas podem ser mantidas em 105, 94, 82, 70 e 58 mAh·g-1 (Figura 6(d)). A uma densidade de corrente de 100 mA·g-1, ele pode ser ciclado de forma estável por mais de 200 vezes, e a eficiência Coulombic é próxima de 100% (Figura 6(e)).
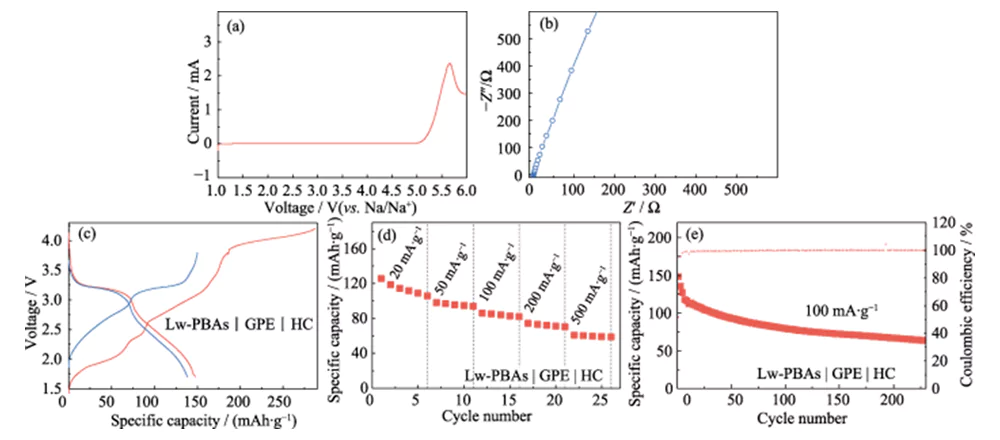
Fig. 6 Desempenho eletroquímico de célula completa de estado quase sólido baseada em cátodo Lw-PBAs e GPE baseado em PEGDA
(a) curva LSV a uma taxa de varredura de 5 mV·s-1; (b) Espectro EIS; (c) Curvas de carga-descarga a uma densidade de corrente de 100 mA·g-1; (d) Avaliar o desempenho em densidades de corrente de 20-500 mA·g-1; (e) Desempenho de ciclismo a 100 mA·g-1; A janela de tensão é de 1,5-3,8 V para todos os testes de célula completa
3 Conclusão
Neste estudo, materiais catódicos de PBAs com baixo teor de água foram preparados por um método de tratamento térmico simples e eficiente. Verificou-se que a remoção de água cristalina não só aumentou a taxa de retenção da capacidade do cátodo dos PBAs de 73% para 88% após 340 ciclos, mas também ajudou a fortalecer a reação redox do Fe2+/Fe3+ de baixa rotação nos PBAs, melhorando assim sua capacidade de armazenamento de sódio. O mecanismo dinâmico de armazenamento de sódio do cátodo dos PBAs e do ânodo HC foi revelado pelas técnicas Raman in situ e XRD in situ. A análise mostrou que o processo de escape de Na+ do cátodo dos PBAs fez com que sua estrutura cristalina mudasse irreversivelmente de cúbica tridimensional, resultando na perda do primeiroa eficiência coulombiana, e a adsorção de Na+ em seus locais defeituosos foi a principal fonte da capacidade de armazenamento de sódio do ânodo HC. Depois de adicionar o compensador de sódio Na2C2O4 (fração de massa 20%) ao cátodo, a primeira capacidade de descarga do cátodo de PBAs aumentou 92,7%. Com base na polimerização térmica de PEGDA iniciada por AIBN, foi desenvolvido um eletrólito quase sólido de alto desempenho com condutividade iônica à temperatura ambiente de 3,51 mS·cm-1 e janela de estabilidade eletroquímica ampliada para 4,9 V (vs. Na/Na+). Com base nisso, um cátodo de PBAs com baixo teor de água com compensador de sódio Na2C2O4 adicionado, ânodo HC e eletrólito sólido de referência PEGDA foram integrados para construir uma bateria de íons de sódio de estado quase sólido que pode ser ciclada de forma estável por mais de 200 vezes em uma densidade de corrente de 100 mA·g-1. Estudos mostraram que a remoção eficiente de água cristalina é um meio necessário para melhorar a estabilidade do ciclo do cátodo dos PBAs e realizar a criação de baterias de íon de sódio de estado quase sólido de alto desempenho.
[1] WANG WL, GANG Y, PENG J, et al. Efeito da eliminação de água no cátodo azul da Prússia para baterias de íon de sódio. Av. Função. Mat., 2022, 32(25): 2111727.
[2] MENG X Y, LIU Y Z, WANG Z Y, et al. Uma célula recarregável de estado quase sólido com alta energia e segurança superior possibilitada pela química redox estável de Li2S em eletrólito em gel. Meio Ambiente Energético. Ciência, 2021, 14(4): 2278.
[3] CHE H Y, CHEN S L, XIE Y Y, et al. Estratégias de projeto de eletrólitos e progresso da pesquisa para baterias de íons de sódio em temperatura ambiente. Meio Ambiente Energético. Ciência, 2017, 10(5): 1075.
[4] LI WK, ZHAO N, BI Z J, et al. Eletrólitos cerâmicos Na3Zr2Si2PO12 para bateria de íons de Na: preparação pelo método de secagem por spray e suas propriedades. J.Inorg. Mat., 2022, 37(2): 189.
[5] LI D, LEI C, LAI H, et al. Avanços recentes na interface entre cátodo e eletrólito sólido granada para todas as baterias de íon-lítio de estado sólido. J.Inorg. Mat., 2019, 34(7): 694.
[6] KIM KJ, BALAISH M, WADAGUCHI M, et al. Baterias de metal-lítio de estado sólido: desafios e horizontes de eletrólitos sólidos de óxido e sulfeto e suas interfaces. Av. Energia Mater., 2021, 11(1): 2002689.
[7] GAO H, GUO B, SONG J, et al. Um eletrólito composto de gel-polímero/fibra de vidro para baterias de íon de sódio. Av. Energia Mat., 2015, 5(9): 1402235.
[8] LIU Y Z, MENG X Y, SHI Y, et al. Baterias sem ânodo de estado quase sólido de longa duração, habilitadas pela engenharia de interface acoplada à compensação de Li. Av. Mater., 2023, 35(42): e2305386.
[9] DU G Y, TAO M L, LI J, et al. Bateria de íon de sódio de estado sólido de baixa temperatura operacional, alta taxa e durável, baseada em eletrólito de polímero e cátodo azul da Prússia. Av. Energia Mater., 2020, 10(5): 1903351.
[10] PENG J, ZHANG W, LIU Q N, et al. Análogos do azul da Prússia para baterias de íons de sódio: passado, presente e futuro. Av. Mat., 2022, 34(15): 2108384.
[11] LU Y H, WANG L, CHENG J G, et al. Azul da Prússia: uma nova estrutura de materiais de eletrodos para baterias de sódio. Química. Comun., 2012, 48(52): 6544.
[12] SÃNGELAND C, MOGENSEN R, BRANDELL D, et al. Ciclagem estável de baterias totalmente de estado sólido de metal de sódio com eletrólitos de polímero à base de policarbonato. Aplicativo ACS. Poli. Mat., 2019, 1(4): 825.
[13] KIM T, AHN S H, SONG Y Y, et al. Eletrólitos sólidos condutores de íons de sódio do tipo azul da Prússia para todas as baterias de estado sólido. Angew. Química. Interno. Ed., 2023, 62(42): e202309852.
[14] SONG J, WANG L, LU Y H, et al. Remoção de H2O intersticial em hexacianometalatos para um cátodo superior de uma bateria de íons de sódio. J. Sou. Química. Soc., 2015, 137(7): 2658.
[15] LIU Y, FAN S, GAO Y, et al. Síntese isoestrutural de análogos do azul da Prússia à base de ferro para baterias de íons de sódio. Pequeno, 2023, 19(43): e2302687.
[16] WANG W, GANG Y, HU Z, et al. Evolução estrutural reversível do azul da Prússia romboédrico rico em sódio para baterias de íons de sódio. Nat. Comun., 2020, 11: 980.
[17] VOCÊ Y, YU X Q, YIN Y X, et al. Hexacianoferrato de ferro e sódio com alto teor de Na como material catódico rico em Na para baterias de íons de Na. Nano Res., 2014, 8(1): 117.
[18] REN W H, QIN M S, ZHU Z X, et al. Ativação de locais de armazenamento de sódio em análogos do azul da Prússia por meio de ataque superficial. Nano Lett., 2017, 17(8): 4713.
[19] ZHANG H, GAO Y, PENG J, et al. Análogos do azul da Prússia com orientação otimizada do plano de cristal e baixos defeitos de cristal para baterias de íons alcalinos de 450 Wh · kg · 1. Angew. Química. Interno. Ed., 2023, 62(27): e202303953.
[20] ZHANG Z H, AVDEEV M, CHEN H C, et al. Análogos litiados do azul da Prússia como materiais ativos de eletrodo positivo para baterias de íon-lítio não aquosas estáveis. Nat. Comun., 2022, 13: 7790.
[21] JIANG M, HOU Z, MA H, et al. Resolvendo a desativação de locais de Fe de baixo spin, redistribuindo a densidade eletrônica em direção ao armazenamento de sódio de alta energia. Nano Lett., 2023, 23(22): 10423.
[22] TANG Z, ZHANG R, WANG H Y, et al. Revelando a formação de poros fechados de resíduos de carbono duro derivado de madeira para baterias avançadas de íons de sódio. Nat. Comun., 2023, 14: 6024.
[23] NIU Y B, GUO Y J, YIN Y X, et al. Compensação de sódio catódico de alta eficiência para baterias de íon de sódio. Av. Mater., 2020, 32(33): e2001419.





