Gel de sal de lítio duplo Eletrólito complexo: preparação e aplicação em massa de lítio-metaly
GUO Yu Xiang, HUANG Liqiang, Gangue WANG, WANG Hongzhi. Complexo de Gel com Sal de Lítio Duplo Eletrólito: Preparação e Aplicação em Bateria de Lítio-Metal. Diário de Materiais Inorgânicos, 2023, 38(7): 785-792 DOI:10.15541/jim20220761
Resumo
O Li metálico é um dos ânodos ideais para íons de lítio de alta densidade de energia bateria devido à sua alta capacidade específica teórica, baixo potencial de redução bem como reservas abundantes. No entanto, a aplicação de ânodos de Li sofre grave incompatibilidade com o eletrólito líquido orgânico tradicional. Aqui, um eletrólito complexo de gel (GCE) com compatibilidade satisfatória com Li metálico o ânodo foi construído por polimerização in situ. O duplo sistema de sal de lítio introduzido no eletrólito pode cooperar com o componente polimérico, que amplia a janela eletroquímica do eletrólito para 5,26 V em comparação com 3,92 V do eletrólito comercial, e obtém um alto teor iônico condutividade de 1 x 10-3 S·cm-1 a 30°C também. Resultados de caracterização morfológica e análise elementar da superfície do ânodo de Li que o GCE exibe um efeito protetor óbvio sobre o metal de lítio sob o condição do sistema duplo de sal de lítio e efeito de volume e crescimento de dendritos do ânodo Li são obviamente inibidos. Ao mesmo tempo, o metal de lítio cheio bateria, montada com material catódico comercial de fosfato de ferro-lítio (LiFePO4), exibe excelente estabilidade de ciclismo e desempenho de taxa. A capacidade a taxa de retenção da bateria atinge 92,95% após 200 ciclos a uma velocidade constante corrente de 0,2C (1C = 0,67 mA·cm-2) a 25 â. Este estudo indica que a CGE pode efectivamente melhorar a segurança, a estabilidade e a desempenho eletroquímico da bateria de metal de lítio, que deverá fornecem uma estratégia para o projeto universal de eletrólitos quase-sólidos.
Palavras-chaveï¼ Li metálico; polimerização in situ; complexo de gel eletrólito
Desde que a meta do “Duplo Carbono” foi colocada Em 2020, a China enfrenta uma reforma do sistema energético sem precedentes. China precisa concluir uma redução profunda das emissões de carbono nos próximos 30 anos, e a energia verde fortalecer-se-á gradualmente até substituir o "monopólio" posição da energia fóssil tradicional. Como uma parte importante das energias renováveis sistema de energia, a tecnologia de baterias de íons de lítio atraiu ampla atenção quando saiu. Atualmente, além de ser o principal fornecedor de energia dispositivo de produtos eletrônicos 3C, a aplicação de baterias de lítio no campos da indústria automobilística, aeroespacial e rede inteligente está gradualmente crescente, o que impõe exigências mais elevadas ao seu desempenho. Em Para obter um alcance de cruzeiro mais longo, as baterias de lítio precisam desenvolver um sistema de bateria com maior densidade de energia. Entre eles, o lítio metálico com capacidade específica ultra-alta (3860 mAh g-1) e baixo potencial de redução Espera-se que (-3,04 V (vs SHE)) se torne o material do ânodo para a próxima geração de baterias de alta densidade energética. No entanto, quando o lítio metálico está em contato com eletrólitos líquidos orgânicos, as reações colaterais continuam a ocorrer no interface, levando ao crescimento incontrolável de dendritos de lítio, perfurando a separador interno da bateria, causando curto-circuitos e até falhas de segurança problemas. Em resposta a este defeito, geralmente é considerado o uso de sólidos eletrólito em vez de eletrólito líquido para melhorar a segurança da bateria. No entanto, sua baixa condutividade iônica à temperatura ambiente e má interface a compatibilidade prejudica seriamente seu desenvolvimento e aplicação.
Neste contexto, o estado de gel eletrólitos capazes de equilibrar contatos interfaciais e condutividade iônica têm recebido atenção crescente. Tan Shuangjie et al desenvolveram um eletrólito em estado de gel não inflamável por imobilização retardante de chama organofosforados em uma matriz polimérica de carbonato de polivinileno com alto resistência mecânica. O eletrólito tem as vantagens de alto teor iônico condutividade e número de transferência de íons de lítio, não inflamabilidade, alta mecânica força e boa compatibilidade eletroquímica. Além disso, o gel o eletrólito formado dentro da bateria por polimerização in situ tem o características de baixa viscosidade, fácil manuseio e forte capacidade de umedecimento, que pode se infiltrar totalmente nos materiais ativos e produzir interface ideal contato, obtendo assim um bom caminho de migração de íons. Por exemplo, Guo Yuguo grupo de pesquisa misturou o monômero tradicional à base de éter 1,3-dioxolano (1,3-Dioxolano, DOL) com 1,2-dimetoxietano (1,2-Dimetoxietano, DME), lítio comercial O hexafluorofosfato (LiPF6) como sal de lítio pode desencadear a abertura do anel polimerização de DOL ao mesmo tempo, e um novo eletrólito em estado de gel que pode operar de forma estável em baterias de lítio-enxofre e baterias catódicas comerciais foi obtido. Embora o polímero à base de poliéter seja um dos mais estáveis eletrólitos para ânodos de metal de lítio, sua estreita janela eletroquímica e baixa condutividade iônica à temperatura ambiente limita sua aplicação em altas energias baterias de densidade. Embora o LiPF6 tenha condutividade iônica ideal e excelente compatibilidade do eletrodo, tem o problema de baixa estabilidade eletroquímica. Portanto, para desenvolver um eletrólito em estado de gel com excelente desempenho, é necessário selecionar hospedeiros poliméricos adequados, sais de lítio e outros componentes.
Para equilibrar o relacionamento entre condutividade, estabilidade de alta tensão e compatibilidade de eletrodo, um O GCE composto sólido-líquido de alto desempenho foi desenvolvido neste estudo. O foi adotado o método de polimerização in situ iniciado termicamente, PEGDA foi usado como monômero, um solvente misto de carbonato de etileno e carbonato de dietila foi adicionado, e LiTFSI e LiDFOB foram introduzidos como o sistema duplo de sal de lítio para trabalhar em conjunto com os componentes do polímero. Ao melhorar o desempenho eletroquímico, a estabilidade da interface entre o eletrólito e o ânodo de metal de lítio é ainda mais aprimorado.
1 Método experimental
1.1 Preparação do GCE
LiTFSI, LiDFOB, CE e DEC (Suzhou Duoduo Chemical Technology Co., Ltd.) são todos materiais de bateria de grau anidro. O Os reagentes EC e DEC foram misturados e LiTFSI e LiDFOB foram pesados e dissolvido no solvente. O eletrólito do sistema de sal duplo preparado (Líquido Eletrólito, LE) era uma solução EC/DEC (proporção de volume 1: 1) de 1 mol/L LiTFSI e LiDFOB 0,2 mol/L. PEGDA (â¥99%, Mn=400) e azobisisobutironitrila (Azodiisobutironitrila, AIBN, 98%) foram adquiridos da Shanghai Aladdin Reagent Co., Ltd. A solução precursora de GCE foi preparada misturando PEGDA e LE, e a fração de massa de PEGDA foi de 10%, 20% e 30%. Adicione 1% de fração de massa de iniciador térmico AIBN e mexa bem. A solução precursora de PEGDA foi aquecida a 70 â por 2 h para obter compósito de gel totalmente polimerizado à base de PEGDA eletrólitos, que foram denominados GCE-x (x=10, 20, 30). Os experimentos acima foram tudo realizado em um porta-luvas anidro e sem oxigênio.
1.2 Montagem da bateria
Conjunto de bateria de célula botão CR2025 (316 aço inoxidável, SS), folha de metal de lítio (14 mm x 0,45 mm, Li), folha de alumínio (grau da bateria). De acordo com diferentes requisitos de teste, baterias SS||SS, Baterias Li||SS, baterias Li||Li e baterias Li||LiFePO4 foram montadas em o porta-luvas. A proporção de massa de LiFePO4, Ketjen Black e Polivinilideno O difluoreto (PVDF) no material catódico é 90: 5: 5, e a capacidade de área é 0,67 mAh·cm-2. Consulte o Material Suplementar S1 para obter detalhes sobre a preparação processo da folha de eletrodo positivo e do processo de montagem da bateria.
1.3 Métodos de caracterização de materiais
Os grupos funcionais e químicos estruturas de monômeros PEGDA e seus polímeros foram analisadas usando um Thermo Espectrômetro infravermelho com transformada de Fourier Nicolet iS50 (transformada de Fourier Espectrômetro Infravermelho, FT-IR) da Thermo Fisher Scientific Corporation do Estados Unidos, com uma faixa de comprimento de onda de 400-4000 cm-1. A cristalinidade de os eletrólitos em estado de gel com diferentes teores de polímero foram caracterizados por um difratômetro de raios X D2 Phaser (difratômetro de raios X, XRD) da Bruker AXS Company, Alemanha, e a faixa de varredura foi de 2θ=5°~80°. O contato OCA40Micro instrumento de medição de ângulo de Pequim Dongfang Defei Instrument Co., Ltd. usado para testar o ângulo de contato de soluções precursoras com diferentes PEGDA conteúdo na superfície da folha de eletrodo LiFePO4. A morfologia microscópica da seção transversal e da superfície da folha metálica de lítio foi observada por um Microscópio eletrônico de varredura de emissão de campo JElectronics JSM-7500F (campo Microscópio Eletrônico de Varredura de Emissão, FESEM). As informações elementares sobre o a superfície da folha metálica de lítio foi analisada usando um equipamento de raios X Escalab 250Xi espectrômetro de fotoelétrons (espectroscopia de fotoelétrons de raios X, XPS) da Thermo Corporação Científica Fisher dos Estados Unidos.
1.4 Teste eletroquímico
A janela de estabilidade eletroquímica do o eletrólito foi testado por voltametria de varredura linear (LSV), a faixa de tensão foi da tensão de circuito aberto (OCV) para 6 V, e a taxa de varredura foi de 1 mV·s-1. O faixa de frequência de espectroscopia de impedância eletroquímica (EIS) é 10-2 ~ 106 Hz, e a tensão de perturbação é de 10 mV. A cronoamperometria foi usada para medir o número de migração de íons de lítio no eletrólito, o potencial diferença foi definida para 10 mV, e o tempo foi de 800 s, e o número de migração de íons de lítio foi obtido de acordo com a fórmula (1):
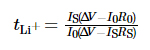
Entre eles, tLi+ é o número de transferência de íons de lítio, ÎV é a diferença de potencial, R0 e RS são a interface valores de impedância do eletrodo e eletrólito antes e depois do teste, respectivamente, e I0 e IS são a corrente do estado inicial e o estado estacionário atual, respectivamente. Os testes acima foram todos realizados no PARSTAT MC estação de trabalho eletroquímica multicanal da AMETEK, EUA. O desempenho do ciclo de carga-descarga de a bateria foi testada usando a plataforma de teste de bateria LAND CT3001A-1U de Wuhan Eletrônica Landian Co., Ltd.
2 Resultados e discussão
2.1 Preparação e análise estrutural de CGE
Neste estudo o PEGDA foi utilizado como monômero AIBN foi usado como iniciador de polimerização, e EC e DEC foram introduzidos como plastificantes. Um eletrólito em estado de gel com um polímero reticulado dimetacrilato de polietilenoglicol (p(PEGDA)) foi sintetizado a 70°C. O a fórmula da reação de polimerização é mostrada na Figura 1 (a). Depois de adicionar o iniciador térmico AIBN, PEGDA com dois grupos C = C terminais ativos rapidamente sofre homopolimerização intermolecular quando aquecido a 70 °C. O ativo cadeias de AIBN fazem com que as cadeias moleculares se conectem entre si ou internamente, e finalmente obter a estrutura do esqueleto da rede p (PEGDA) e com sucesso usar o método de polimerização in-situ para obter o eletrólito em estado de gel dentro da bateria. Como mostrado na Figura S1, as três soluções precursoras com diferentes conteúdos de PEGDA mostraram boa molhabilidade no LiFePO4 positivo folha de eletrodo, que é a chave para obter um bom contato interfacial entre o eletrólito e o eletrodo.
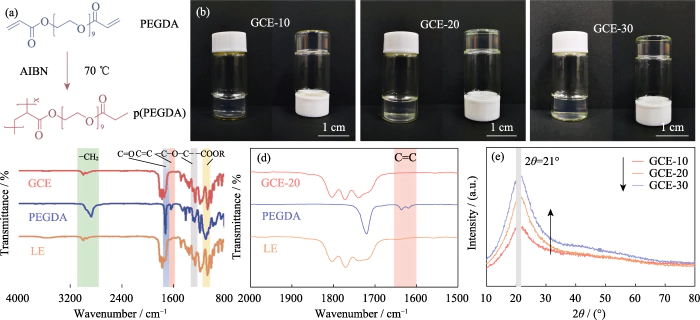
Fig. 1 Preparação e análise estrutural do GCE
(a) Polimerização reação do PEGDA; (b) Fotografias ópticas de GCE-x; (c, d) FT-IR espectros de GCE-20, PEGDA e LE; (e) padrões de XRD de GCE-x; Colorido os números estão disponíveis no site
Para obter GCE com alto teor iônico condutividade, LiTFSI, que possui um alto grau de dissociação no polímero, foi usado como sal de lítio, e LiDFOB 0,2 mol/L foi introduzido para construir a rede de gel do sistema de sal duplo. LiDFOB tem boa solubilidade e estabilidade térmica, especialmente nas propriedades de formação de filme. Quando carbonato solventes estão em contato com ânodos de metal de lítio, um grande número de materiais soltos camadas de deposição de lítio porosas ou dendríticas provavelmente serão formadas no superfície do metal de lítio. A introdução do LiDFOB pode ajudar na formação de interfase de eletrólito sólido livre de HF (Eletrólito Sólido Camada interfase, SEI) e melhora a compatibilidade com ânodos de metal de lítio. Ao mesmo tempo, o LiTFSI tem um efeito corrosivo nos coletores de corrente metálicos, enquanto o LiDFOB pode passivar o metal de alumínio e aliviar o efeito de corrosão do LiTFSI em coletores atuais. No entanto, o eletrólito de sal único do LiDFOB exibiu impedância mais alta do que o eletrólito de sal duplo LiTFSI-LiDFOB do mesma concentração. Como mostrado na Figura S2, a bateria Li||LiFePO4 foi montado usando eletrólitos de gel LiDFOB e LiTFSI-LiDFOB 1,2 mol/L, respectivamente, e a impedância da bateria LiTFSI-LiDFOB foi significativamente menor.
Os resultados da pesquisa existente mostram que o LiTFSI e o LiDFOB podem ter um efeito sinérgico, melhorando efetivamente o compatibilidade do eletrólito com o ânodo metálico de lítio. Jiao Shuhong e outros al. usou XPS e FT-IR para descobrir que o eletrólito de sal duplo de LiTFSI e LiDFOB pode passivar o coletor de corrente de alumínio do eletrodo positivo e formar uma camada SEI estável na superfície do negativo de metal de lítio eletrodo para alcançar um ciclo estável de longo prazo de baterias de metal de lítio. Sobre nesta base, Liu Yue et al. [26] usaram simulação de dinâmica molecular híbrida para estudar o mecanismo de ação conjunta de LiTFSI e LiDFOB em lítio metálico baterias e explicou o efeito protetor do LiTFSI no LiDFOB. Estudos mostraram que a ligação BO do LiDFOB é relativamente a mais fraca e propensa a quebra. O LiDFOB se decomporá rapidamente sob a ação dos radicais livres e reagem com o metal de lítio para produzir átomos livres de Li0 e boro. O átomo de boro A reação de inserção faz com que as moléculas de solvente no eletrólito se se decompor, e os fragmentos moleculares resultantes continuarão a reagir com fragmentos moleculares de sal de lítio e átomos de boro. No sistema de sal de dilítio, no entanto, o LiTFSI se decompõe preferencialmente, contando com o "sacrifício mecanismo" para proteger o LiDFOB, a taxa de decomposição do LiDFOB é significativamente reduzido. Reduzindo assim o número de átomos livres de Li0 e boro, que pode otimizar a camada SEI e proteger o ânodo metálico de lítio.
Conforme mostrado na Figura 1(b), GCE-x é uniforme e transparente gelatinoso, não mais fluido. Para verificar ainda mais o monômero polimerização, FT-IR foi utilizado para caracterizar as estruturas químicas de LE, Monômero PEGDA e GCE-20. Como mostrado na Fig. 1 (c), todas as três amostras mostram o pico de absorção típico da vibração de estiramento C=O (~1726 cm-1). O pico de absorção em 1280 cm-1 de GCE corresponde ao antissimétrico e picos de alongamento simétrico da ligação éter, indicando que -(CH2CH2)n- em o monômero não é destruído durante a polimerização. Os picos em 1095 e 2867 cmâ1 pertencem a -COOR e -CH2, respectivamente. Como mostrado na Figura 1 (d), o pico característico da ligação C = C do PEGDA é localizado em 1616-1636 cm-1, mas desaparece no GCE, indicando que PEGDA tem foi polimerizado completamente.
Como os íons de lítio migram apenas no região amorfa do GCE, reduzindo a cristalinidade do eletrólito é benéfico para melhorar a condutividade iônica. A Figura 1 (e) é o padrão XRD de GCE-x. Todos os três tipos de amostras têm um pico de absorção de difração único a 2θ=21°, indicando que o eletrólito preparado possui uma região amorfa acompanhado por uma pequena quantidade de cristalitos. Como o conteúdo do PEGDA aumenta, a área de pico do espectro aumenta significativamente, o proporção da região amorfa do eletrólito em gel diminui, e a o conteúdo de componentes amorfos no eletrólito diminui, o que não é propício à migração de íons.
2.2 Desempenho eletroquímico do GCE e Análise de compatibilidade de metal Li
Para estudar a compatibilidade de eletrólitos com diferentes conteúdos de polímero com ânodos de metal de lítio em baterias, os espectros de impedância de baterias simétricas Li || Li com GCE-x eletrólitos no estado inicial foram analisados (conforme mostrado na Figura S3). No figura, os valores de impedância de interface das baterias GCE-10 e GCE-20 são ambas pequenas, 93 e 152 Ω, respectivamente, e a bateria GCE-30 chega a 409 Ω. Mostra que a migração de íons de lítio em GCE com maior teor de polímero necessita superar uma barreira migratória maior, que não conduz à rápida condução de íons de lítio na interface.
Observando o sobrepotencial do Li||Li bateria simétrica no teste do ciclo de carga-descarga, podemos saber o potencial diferença gerada pela migração do par de íons durante este processo, e então avaliar o comportamento de deposição/remoção de lítio. A Figura S4 mostra o curvas tensão-tempo da célula simétrica Li||Li do GCE-x. A temperatura de teste era de 25 â, e a bateria foi carregada e descarregada sob uma corrente constante com capacidade específica de 0,5 mAh cm-2 e densidade de corrente de 0,5 mA cm-2. O sobrepotencial inicial das células Li|GCE-10|Li foi de 22 mV, e a voltagem aumentou para 137 mV após 250 h. O sobrepotencial do simétrico GCE-30 bateria era de 104 mV no estágio inicial, e o sobrepotencial aumentou rapidamente em os ciclos subsequentes, atingindo um valor de pico de 509 mV em 227 h e então caiu drasticamente, indicando que a bateria teve um curto-circuito interno. Em Em contraste, a bateria GCE-20 pode operar com um baixo sobrepotencial próximo a 30 mV, e tem o desempenho eletroquímico mais estável. A seguir focaremos o eletrólito GCE-20.
A condutividade iônica de um eletrólito reflete diretamente a capacidade dos íons de migrar em um campo elétrico. O a condutividade iônica de LE e GCE-20 foi testada em 60, 50, 40, 30, 20, 10 e 0 â, respectivamente. Como mostrado na Figura 2 (a), a condutividade iônica do GCE-20 em 30 °C é 1,00 mS cm-1, e quando a temperatura do teste sobe para 60 °C, o a condutividade atinge 1,39 mS cm-1. Isto ocorre porque a energia de ativação diminui com o aumento da temperatura de teste e a atividade de movimento de segmentos da cadeia polimérica e aumentos de íons de lítio. No entanto, a velocidade de movimento dos segmentos da cadeia polimérica é obviamente afetado pela temperatura, então o a condutividade do eletrólito do gel GCE-20 muda mais do que a do eletrólito solução.
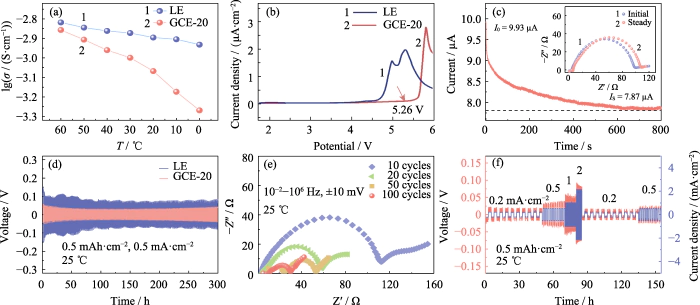
Fig. 2 Desempenho eletroquímico do GCE-20
(a) Iônico condutividades de LE e GCE-20; (b) curvas LSV de LE e GCE-20; (c) Perfil de tempo atual da célula Li | GCE-20 | Li com inserção mostrando correspondente Parcelas de Nyquist; (d) Curvas tensão-tempo de células simétricas de Li||Li montadas com LE e GCE-20; (e) Gráficos de Nyquist da célula Li|GCE-20|Li após ciclagem; (f) Curvas tensão-tempo e densidade-tempo de corrente da célula Li|GCE-20|Li; Colorido os números estão disponíveis no site
Melhorando a densidade de energia das baterias requer garantir a estabilidade do eletrólito em altas tensões operacionais. Estudos demonstraram que eletrólitos à base de polímeros coordenados por carbonila geralmente têm uma ampla janela eletroquímica e boa estabilidade em altas temperaturas operacionais tensões. A Figura 2 (b) mostra que a curva LSV da bateria GCE-20 começa a flutua significativamente em 5,26 V, e pode-se considerar que o janela eletroquímica do eletrólito em gel GCE-20 atinge 5,26 V. Em Em contraste, a janela eletroquímica do eletrólito comercial é de apenas 3,92 V. Portanto, o eletrólito em estado de gel tem excelente estabilidade eletroquímica em alta tensão.
Além disso, a migração de íons de lítio O número do eletrólito também é um dos indicadores para medir o lítio condutividade iônica. É definido como a razão entre o número de íons de lítio passando por uma seção do eletrólito perpendicular à direção de migração de íons de lítio por unidade de tempo para a soma de ânions e cátions que passam através da seção. Quanto maior o valor, maior a proporção de lítio íons no processo de migração iônica e maior a eficiência da migração. A Figura 2 (c) é a curva cronoamperométrica da bateria Li|GCE-20|Li, onde a inserção é a comparação da impedância eletroquímica da bateria antes e depois do teste. De acordo com a fórmula (1), o número de migração de íons de lítio do GCE-20 é 0,21. A introdução de aditivos ou dopagem com substâncias inorgânicas enchimentos podem obter uma taxa de migração de íons de lítio mais alta, o que não é apenas benéfico para melhorar a taxa de carga e descarga da bateria, mas também melhorar a estabilidade do seu ciclo.
Durante o processo de carga e descarga da bateria simétrica Li||Li, os ânions e cátions no eletrólito sofrem contra-migração. Ao carregar, os íons de lítio migram para o negativo eletrodo, e os ânions migram para o eletrodo positivo, e o oposto é verdadeiro ao descarregar. Portanto, durante o processo de carga e descarga, o gradiente de concentração de íons entre os eletrodos positivo e negativo e o campo elétrico embutido aumenta gradativamente, dificultando o movimento oposto de ânions e cátions, resultando em polarização de concentração dentro do bateria, resultando em uma mudança no sobrepotencial. Conforme mostrado na Figura 2 (d), o A bateria Li | GCE-20 | Li tem um sobrepotencial de 46 mV após um ciclo estável de 300 h. No entanto, o sobrepotencial gerado pela bateria Li|LE|Li durante o teste é significativamente maior do que a bateria Li | GCE-20 | Li (65 ~ 118 mV). Esse é porque os crescentes dendritos de lítio causam curtos-circuitos suaves em alguns sites internos. Os resultados mostram que o comportamento eletroquímico dentro do A bateria GCE-20 é mais ideal. A Figura 2 (e) é o teste EIS do simétrico bateria após 10, 20, 50 e 100 ciclos. Como o número de carga-descarga aumenta, a impedância da bateria tende a diminuir. Durante este processo, uma camada SEI estável foi construída entre o eletrólito e o metal de lítio interface, e o contato da interface foi otimizado, para que a interface a impedância diminuiu significativamente.
A 25 , a bateria Li|GCE-20|Li foi submetido a 10 ciclos de carga-descarga em densidades de corrente de 0,2, 0,5, 1, 2, 0,2 e 0,5 mA cm-2, respectivamente. A Figura 2 (f) reflete a tendência do sobrepotencial da célula simétrica ao longo do tempo durante este processo. O o sobrepotencial em baixa densidade de corrente é pequeno e pode permanecer relativamente estável. Depois que a densidade de corrente aumenta, o sobrepotencial aumenta de acordo, e não há aumento/diminuição repentinos na tensão durante o processo.
A morfologia do revestimento da folha de lítio após o ciclo pode caracterizar visualmente o comportamento de deposição/remoção de lítio dentro da bateria. A bateria simétrica Li||Li foi desmontada após carga e descarga por 100 horas com capacidade de 0,5 mAh cm-2 e corrente densidade de 0,5 mA cm-2, e a morfologia microscópica da seção transversal e superfície da folha metálica de lítio foi observada pela FESEM. Como mostrado na Figura 3(a, b), a espessura da folha de lítio pura não tratada é de 353 µm, e a superfície é plana e lisa. A interação entre o eletrólito líquido e o metal de lítio leva à deposição de um grande número de materiais soltos e porosos camadas de deposição de lítio na superfície da folha de lítio do Li|LE|Li bateria, principalmente na forma de musgo fino e irregular. Quando a espessura do folha de metal de lítio aumenta para 446 µm, há uma expansão de volume óbvia efeito, e um grande número de dendritos são gerados. Em contrapartida, o espessura da folha de lítio na bateria Li | GCE-20 | Li é 391 Î1⁄4m, e o A camada de deposição superficial é densa e uniforme, e não há nenhuma camada finamente dividida revestimento de lítio (Fig. 3 (c)). Isso mostra que o eletrólito em estado de gel pode suprime efetivamente a expansão de volume do ânodo de metal de lítio. LiDFOB em GCE-20 pode auxiliar na formação de uma camada SEI estável para equilibrar o interno potencial da bateria e retardar o crescimento de dendritos de lítio induzindo deposição uniforme de lítio. Portanto, até certo ponto, pode otimizar o comportamento de deposição/decapagem de lítio e protege o ânodo de metal de lítio.

Fig. 3 imagens SEM de Li metálico
Seção transversal (acima) e imagens SEM de vista superior (abaixo) de (a) deposição metálica fresca de Li e lítio morfologia em células Li||Li simétricas com (b) LE e (c) GCE-20
Posteriormente, análise de elementos de superfície XPS foi usado para explorar a composição da camada SEI na superfície do ânodo de metal de lítio sob a ação do sistema de sal duplo LiTFSI-LiDFOB CGE. A Figura S5 é o espectro XPS da superfície do ânodo de metal de lítio usando LE e GCE-20. O espectro de C1s (Fig. S5 (a, d)) possui principalmente 4 picos de sinal, correspondendo a CC/CH em 284,8 eV. Os dois picos em 286,4 e 289,4 eV correspondem a C-O e C=O, respectivamente, e são derivados principalmente do produtos de decomposição de solventes carbonáticos (como ROCO2-, ROC-, etc.). O pico em 292,7 eV corresponde a CF3, que é derivado principalmente do produtos de decomposição de sais de lítio. No espectro O1s (Figura S5 (b, e)), os picos em 531,1 e 532,3 eV correspondem a C=O e CO, respectivamente, e o conteúdo relativo de C-O é significativamente reduzido, o que está principalmente relacionado à diminuição do conteúdo de produtos de decomposição. Sob a junta ação de LiTFSI e LiDFOB, a formação de LiOCH3, Li2O2C2H4 e outros subprodutos é restrito. Em adiçãoitção, ao contrário de LE (Fig. S5 (e)), nos F1s espectro de GCE-20 (Fig. S5 (f)), o pico do sinal de LiF está em 684,5 eV, e LiF pode auxiliar na formação de uma camada SEI densa e estável.
2.3 Análise de desempenho eletroquímico de Bateria Li||LiFePO4
LiFePO4 tem as vantagens de alta capacidade, ciclo de vida longo e excelente segurança, e é um fator positivo dominante material ativo do eletrodo. Sua capacidade específica teórica é de 170 mAh·g-1. No 25 â, a bateria Li|GCE-20|LiFePO4 foi carregada e descarregada 200 vezes a uma velocidade corrente constante de 0,2C (1C=0,67 mA·cm-2). Conforme mostrado na Figura 4 (a, b), o a capacidade específica de descarga do primeiro ciclo é de 141,4 mAh·g-1. A quitação a capacidade específica da 200ª volta é de 131,4 mAh·g-1, a capacidade de retenção a taxa atinge 92,95% e a redução da capacidade de giro único é inferior a 0,04%. O a tensão da plataforma é estável, de acordo com as características do LiFePO4 baterias. Eficiência coulombiana, como importante indicador para avaliação de bateria estabilidade do ciclo, refere-se à proporção entre a capacidade de descarga da bateria e a carga capacidade durante o mesmo ciclo. A eficiência coulombiana do primeiro ciclo do A bateria Li | GCE-20 | LiFePO4 é de 97,8%. Devido à formação da camada SEI durante o processo de descarga do primeiro ciclo, parte da capacidade irreversível é gerado, resultando em uma baixa eficiência coulombiana do primeiro ciclo.
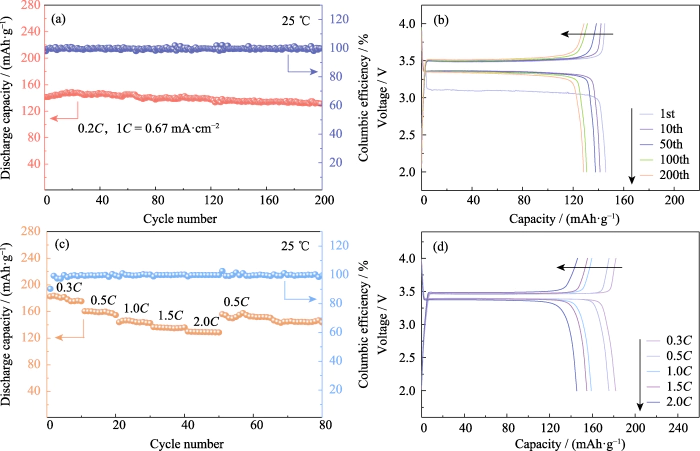
Fig. 4 Desempenho eletroquímico do Células Li|GCE-20|LiFePO4
(a) Ciclismo desempenho e (b) curvas de tensão-capacidade correspondentes a 0,2C; (c) Taxa de desempenho e (d) curvas de tensão-capacidade correspondentes; Colorido os números estão disponíveis no site
Além disso, testes de carga e descarga foram realizados em Li|GCE-20|LiFePO4 a 0,3C, 0,5C, 1C, 1,5C e 0,5C correntes para explorar seu desempenho de taxa. Como mostrado na Fig. 4 (c), quando o taxa de corrente é de 0,5C, a capacidade específica de descarga do primeiro ciclo do a bateria é de 160,2 mAh·g-1. À medida que a taxa atual aumenta, a descarga específica a capacidade da bateria diminui dentro de uma faixa controlável. A taxa é aumentado para 2C, e a capacidade específica do primeiro ciclo da carga é 130 mAh·g-1. Posteriormente, a taxa atual voltou novamente para 0,5°C, e o a capacidade específica da descarga do primeiro ciclo foi de 156,1 mAh·g-1. O relevante curvas de tensão-capacidade são mostradas na Figura 4 (d). A tensão de platô em diferentes taxas é estável sem causar um aumento no sobrepotencial, e o a bateria mostra bom desempenho e reversibilidade.
3 Conclusão
O GCE baseado em PEGDA foi desenvolvido termicamente iniciando a polimerização in situ. A análise de caracterização FT-IR e XRD do GCE, combinado com testes eletroquímicos, selecionou o GCE ideal formulação. Monte ainda mais a bateria para estudar a eletroquímica Desempenho do eletrólito e analisar o efeito protetor do eletrólito no eletrodo negativo de metal de lítio, observando o morfologia microscópica e caracterização de elementos de superfície do metal lítio, explicando:
1) O GCE-x (x=10, 20, 30) preparado por a polimerização in-situ pode molhar bem a folha do eletrodo e o eletrólito tem a melhor estabilidade eletroquímica quando a fração de massa do PEGDA é 20%.
2) O sistema de sal de dilítio de LiTFSI e É introduzido o LiDFOB, que pode formar uma boa interação com o polímero componentes. O eletrólito possui ampla janela eletroquímica (5,26 V) e alta condutividade iônica (30 â, 1×10-3 S·cm-1). Ao mesmo tempo, o sal dilítio sistema pode ser usado para construir uma camada SEI estável e proteger efetivamente o ânodo de metal de lítio.
3) Usando GCE-20 para combinar com o comercial Material de cátodo LiFePO4, a bateria completa montada pode carregar de forma estável e descarga por 200 ciclos a uma corrente de 0,2C, com taxa de retenção de capacidade de 92,95% e apresenta bom desempenho de taxa.
Em resumo, este trabalho obteve um resultado seguro e excelente desempenho eletroquímico do GCE, que fornece um efeito eficaz solução para o desenvolvimento de lítio seguro e estável de alta densidade energética baterias de metal.
Material adicional:
Processo de preparação da bateria S1
Misture e moa LiFePO4, Ketjen Black e PVDF de acordo com a proporção alvo, adicione o solvente N-Metilpirrolidona (N-Metilpirrolidona, NMP), agitar e dispersar totalmente e obter uma solução uniforme e pasta de material ativo viscoso. A pasta foi raspada e revestida no alumínio folha com um revestidor plano, depois transferida para um forno a vácuo e seca a 80 °C por 12h. Após cortar a folha do eletrodo, seque-a novamente e transfira-a para uma porta-luvas anidro e sem oxigênio.
Uma junta, estilhaços e folha de metal de lítio foram colocados no centro da caixa do eletrodo negativo em sequência, e o a espessura da folha metálica de lítio era de 0,35 mm. Posteriormente, o precursor solução de GCE foi adicionada gota a gota no centro da superfície do negativo eletrodo (50 µL) usando uma pistola de pipeta e, em seguida, a bateria Celgard 2500 separador e a folha de eletrodo positivo (separador de bateria Celgard 2500) foram colocados em sequência. Antes de montar a bateria Li||LiFePO4, o a peça polar positiva foi pesada e o carregamento de material ativo foi registrado. A carga superficial do material ativo do eletrodo positivo LiFePO4 foi de 3,94 mgcm-2. Finalmente, pressurize e sele a bateria em uma máquina seladora de bateria, transferi-lo para um ambiente a 70 °C e aqueça-o durante 2 h para iniciar polimerização para obter um eletrólito em estado de gel. Para garantir que o eletrólito se infiltra totalmente na peça polar do LiFePO4, a bateria precisa ser deixado em repouso por 1 hora após a montagem.
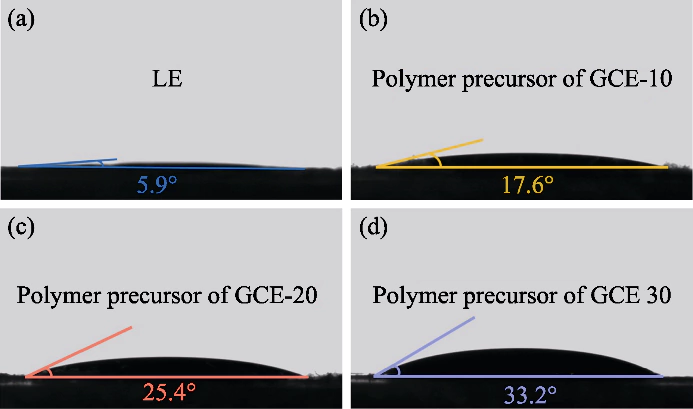
Fig. S1 Ângulos de contato entre a solução precursora de polímero e os cátodos
(a) LE; (b) GCE-10; (c) GCE-20; (d) GCE-30
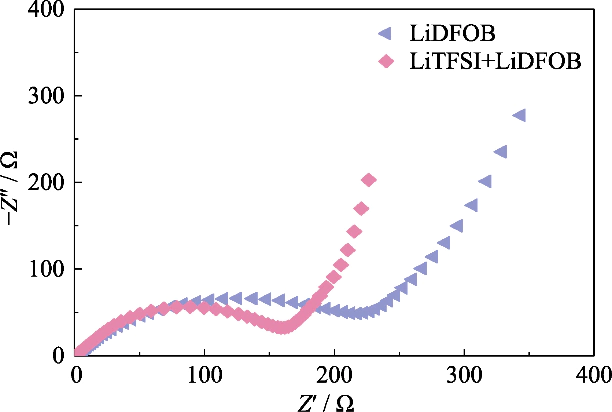
Fig. S2 Gráficos Nyquist de células Li || LiFePO4 montadas em GCE com diferentes sais de lítio
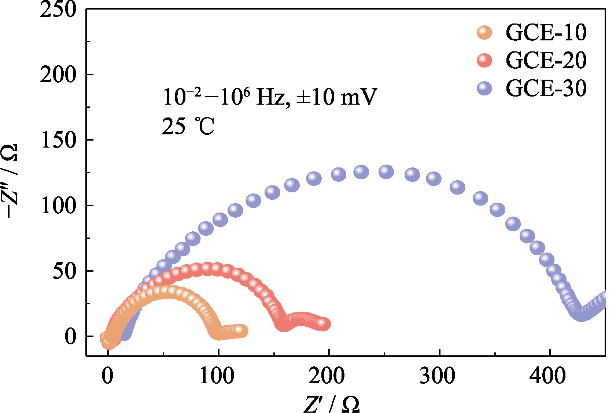
Fig. S3 Gráficos de Nyquist de células Li||Li simétricas montadas com eletrólitos GCE-x
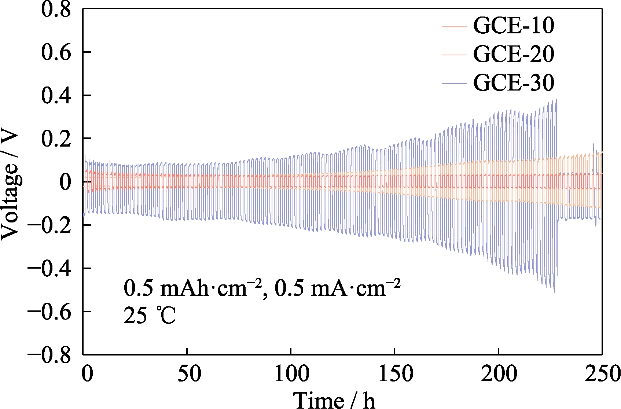
Fig. S4 Vperfis de tensão-tempo de células simétricas de Li||Li montadas com eletrólitos GCE-x
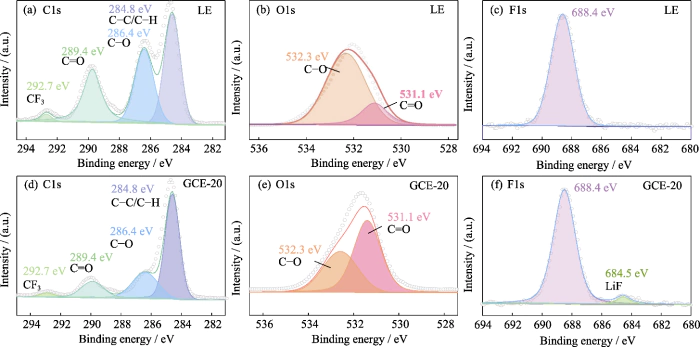
Fig. S5 XPS espectros de ânodo metálico de Li em células simétricas de Li||Li
(a, d) C1s, (b, e) O1s, (c, f) F1s Espectros XPS de ânodo metálico de Li com (a-c) LE e (d-f) GCE-20
[1] BOM J B, KIM Y.
Desafios para baterias recarregáveis de lítio
Química de Materiais, 2010, 22(3):587.
[2] ZHAO J, LIAO L, SHI F, et al.
Fluoração de superfície de materiais reativos de ânodo de bateria para maior estabilidade
Diário do Sociedade Americana de Química, 2017, 139(33):11550.
[3] TARASCON J M, ARMAND M.
Problemas e desafios enfrentando baterias de lítio recarregáveis
Natureza, 2001, 414(6861):359.
[4] ZHI J, YAZDI A Z, VALAPPIL G, et al.
Sólido artificial interfase eletrolítica para sistemas aquosos de armazenamento de energia de lítio
Avanços da Ciência, 2017, 3(9):e1701010.
[5] JUN K, SUN Y, XIAO Y, et al.
Lítio superiônico condutores com estruturas de compartilhamento de canto
Materiais Naturais, 2022, 21: 924.
[6] LIU J, BAO Z, CUI Y, et al.
Caminhos para baterias práticas de metal de lítio de alta energia e ciclo longo
Energia da Natureza, 2019, 4(3):180.
[7] DUNN B, KAMATH H, TARASCON J M.
Energia elétrica armazenamento para a rede: uma bateria de escolhas
Ciência, 2011, 334(6058):928.
[8] MAUGER A, JULIEN C M, PAOLELLA A, et al.
Construindo melhor baterias no estado sólido: uma revisão
Materiais, 2019, 12(23):3892.
[9] MANTHIRAM A, YU X, WANG S.
Bateria de lítio químicas possibilitadas por eletrólitos de estado sólido
Resenhas da Natureza Materiais, 2017, 2(4):16103.
[10] ZHOU D, SHANMUKARAJ D, TKACHEVA A, et al.
Eletrólitos de polímero para baterias à base de lítio: avanços e perspectivas
Química, 2019, 5(9):2326.
[11] TAN S J, YUE J, TIAN Y F, et al.
Encapsulamento in situ de fosfato retardador de chama em matriz polimérica robusta para baterias metálicas de lítio de estado quase sólido seguras e estáveis
Armazenamento de energia Materiais, 2021, 39: 186.
[12] ZHAO Q, LIU X, STALIN S, et al.
Polímero de estado sólido eletrólitos com transporte interfacial rápido integrado para lítio secundário baterias
Energia da Natureza, 2019, 4(5):365.
[13] ZHOU Z, FENG Y, WANG J, et al.
Um robusto, altamente Pele extensível condutora de íons para baterias de metal de lítio estáveis
Engenharia Química Diário, 2020, 396: 125254.
[14] WILKEN S, TRESKOW M, SCHEERS J, et al.
Estágios iniciais de decomposição térmica de eletrólitos de bateria de íon de lítio baseados em LiPF6 por Raman e RMN detalhados espectroscopia
RSC Avanços, 2013, 3(37):16359.
[15] LIU F Q, WANG W P, YIN Y X, et al.
Atualizando o tradicional eletrólito líquido por meio de gelificação in situ para futuro lítio baterias metálicas
Avanços da Ciência, 2018, 4(10):eaat5383.
[16] XU C, SUN B, GUSTAFSSON T, et al.
Camada de interface formação em baterias de lítio com eletrólito polimérico sólido: um estudo XPS
Diário de Materiais Química A, 2014, 2(20):7256.
[17] WEI Z, CHEN S, WANG J, et al.
Íon de lítio superior condução de eletrólito polimérico com estrutura semelhante a um pente via sem solvente copolimerização para bateria de lítio bipolar totalmente em estado sólido
Diário de Materiais Química A, 2018, 6(27):13438.
[18] DI NOTO V, LAVINA S, GIFFIN G A, et al.
Eletrólitos de polímero: presente, passado e futuro
Eletroquímica Acta, 2011, 57(15):4.
[19] XUE Z, HE D, XIE X.
Poli(etileno eletrólitos à base de óxido) para baterias de íons de lítio
Diário de Materiais Química A, 2015, 3(38):19218.
[20] MINDEMARK J, LACEY M J, BOWDEN T, et al.
Além PEO-Materiais hospedeiros alternativos para eletrólitos de polímero sólido condutor de Li+
Progresso em Polímero Ciência, 2018, 81: 114.
[21] ARAVINDAN V, GNANARAJ J, MADHAVI S, et al.
Íon de lítio conduzindo sais eletrolíticos para baterias de lítio
Chemistry-A European Journal, 2011, 17(51):14326.
[22] XU K.
Eletrólitos e interfases em baterias de íon-lítio e além
Revisões Químicas, 2014, 114(23):11503.
[23] YANG H, ZHUANG G V, ROSS JR P N.
Estabilidade térmica de Sal LiPF6 e bateria de íons de lítio eletrólitos contendo LiPF6
Diário do Poder Fontes, 2006, 161(1):573.
[24] LI Q, LIU G, CHENG H, et al.
Baixa temperatura projeto de eletrólito para baterias de íon-lítio: perspectivas e desafios
Química-Um Europeu Diário, 2021, 27(64):15842.
[25] JIAO S, REN X, CAO R, et al.
Ciclagem estável de baterias de metal de lítio de alta tensão em eletrólitos de éter
Energia da Natureza, 2018, 3(9):739.
[26] LIU Y, YU P, SUN Q, et al.
Operação prevista polimerização no ânodo de lítio por meio de inserção de boro
Cartas de Energia da ACS, 2021, 6(6):2320.
[27] CAO W, LU J, ZHOU K, et al.
Orgânico-inorgânico SEI composto para um ânodo de metal de lítio estável por polimerização in-situ
Nano Energia, 2022, 95: 106983.
[28] CHENG S, SMITH D M, LI C Y.
Como funciona a nanoescala estrutura cristalina afeta o transporte de íons em eletrólitos poliméricos sólidos?
Macromoléculas, 2014, 47(12):3978.
[29] JOHANSSON P.
Primeiros princípios modelagem de eletrólitos poliméricos amorfos: complexos Li+-PEO, Li+-PEI e Li+-PES
Polímero, 2001, 42(9):4367.
[30] SUN B, MINDEMARK J, EDSTRÃM K, et al.
À base de policarbonato eletrólitos de polímero sólido para baterias de íon-lítio
Solid State Ionics, 2014, 262: 738.
[31] SILVA M M, BARROS S C, SMITH M J, et al.
Caracterização de eletrólitos de polímero sólido à base de poli (trimetilenocarbonato) e lítio tetrafluoroborato
Electrochimica Acta, 2004, 49(12): 1887.
[32] BARBOSA P, RODRIGUES L, SILVA M M, et al.
Caracterização de pTMCnLiPF6 eletrólitos de polímero sólido
Solid State Ionics, 2011, 193(1):39.